肠道是体内极其重要的“代谢-免疫-微生态菌群”相互作用及彼此调节的器官,其稳态维持对于整个机体的正常生理功能起着关键的调控作用。小肠具有独特的双向营养供给环境,包括从肠内吸收“吃进来”的饮食营养及微生物菌群来源的代谢物(肠腔面营养)以及经由血管供给到小肠的系统循环营养代谢物(血供面营养)。这种“肠内-肠外”双向营养供应模式是小肠生理的显著特征,其失衡与肠道功能异常、免疫屏障受损、系统代谢紊乱如肥胖和心血管疾病的发生密切相关。但不同营养供应如何差异性调控小肠生理,包括宿主防御和系统代谢平衡仍不清楚。
10月19日,浙江大学基础医学院王迪团队联合浙江大学爱丁堡大学刘琬璐团队及中国科学院上海药物研究所刘佳团队在Cell杂志发表了文章A two-front nutrient supply environment fuels small intestinal physiology through differential regulation of nutrient absorption and host defense,该研究系统性阐明了小肠双向营养供给环境的核心特征与动态规律,可视化了不同营养路径和营养种类在小肠吸收过程中的时空差异及其对机体防御(包括黏膜免疫和屏障功能)和营养吸收(包括脂质吸收和整体代谢)的调控作用,同时揭示了肠内营养供给紊乱引发肠道脂质过度吸收进而加剧心血管疾病发生发展的机制。

为了明确不同营养供应的调控作用,研究人员设计了三种营养供给模式:1.对照组小鼠,自由进食饲料并由静脉给予生理盐水;2.肠外营养组小鼠,剥夺饲料并由静脉给予肠外营养液(与对照组等能量);3.禁食组小鼠,剥夺饲料并由静脉给予生理盐水。通过系统描绘包含“代谢物-蛋白质-微生物-宿主”多维度的小肠双向营养供给环境,发现肠腔面营养会显著提高脂质和胆汁酸代谢物及其相关肠道菌的丰度,而血供面营养则富集碳水化合物及有机酸。在生理功能层面上发现肠腔面营养促进脂质吸收、上皮屏障完整以及肠道荷尔蒙的产生,而血供面营养主要支持DNA合成、胞外基质构成以及免疫调节等。
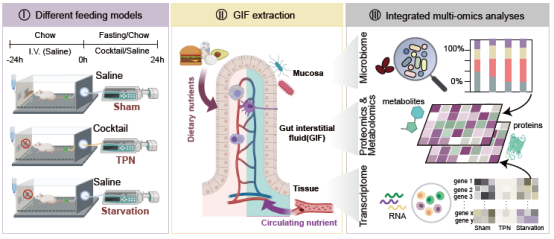
肠道双向营养供给实验模型及多维度生物学特征整合分析模式图
小肠具有高度组织化的绒毛-隐窝(villus-crypt)结构单元,其中包含多样的细胞类型并在空间分布上存在异质性并呈现出功能区域化(functional zonation)的特征。不同供应模式提供的营养在小肠中的吸收特征及其功能意义是否一样?通过荧光标记营养物质体内示踪和MALDI-MSI技术,研究人员发现肠腔面供给的营养在小肠吸收具有空间分布差异及细胞类型偏好性,主要表现为脂质在绒毛顶端吸收且杯状细胞偏好性摄取谷氨酰胺,而血供面来源的营养物质则表现为均一性吸收。
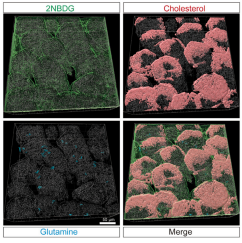
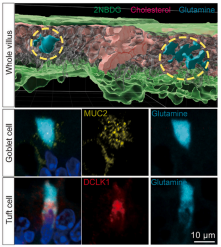
肠内营养吸收的绒毛区域及细胞类型差异性
谷氨酰胺作为体内含量最高的游离氨基酸,早在上世纪90 年代就被证明能够有效缓解包括短肠综合征、慢性腹泻以及炎症性肠病等在内的肠道损伤(1),但其作用机制仍不明确。研究人员通过MALDI-MSI技术结合AB/PAS染色发现,杯状细胞偏好性摄取的谷氨酰胺对于维持其胞内的氧化还原平衡至关重要。进一步通过缺失谷氨酰胺饲料喂养及谷氨酰胺转运蛋白抑制剂处理发现,缺失肠腔面谷氨酰胺摄取会显著抑制杯状细胞的粘液生成,进而导致肠道粘液免疫的破坏。
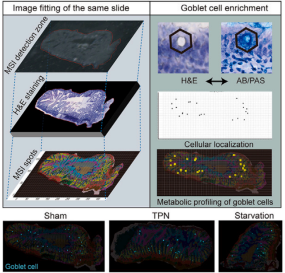
小肠绒毛代谢物分布的空间差异以及谷氨酰胺对粘液免疫的塑造作用
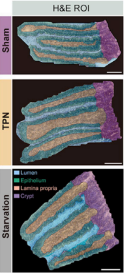
全肠外营养(total parenteral nutrition,TPN)是临床上给予肠道功能严重损坏患者的重要营养支持手段,但会引起肠道屏障受损等一系列并发症(2)。肠道屏障主要由杯状细胞分泌形成的粘液层(mucus layer)、上皮细胞紧密排列组成的上皮屏障及免疫细胞共同组成。研究人员通过单细胞转录组、代谢组及真菌多样性检测发现,在只有肠外营养供给时会引起肠道特定真菌及相关代谢产物细胞松弛素H(cytochalasin H)的显著增加,进而导致上皮细胞间紧密连接受损。更重要的是,抗真菌药物处理能够挽救由于肠外营养供给引起的肠道屏障受损。这为临床治疗全肠外营养引起的肠道并发症提供了新的观点及潜在治疗方案。
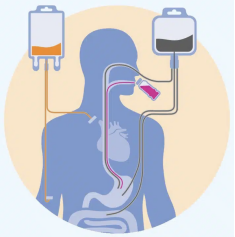
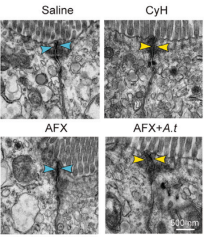
临床上全肠外营养(TPN)通过真菌及其代谢物影响正常的肠道屏障功能
健康的饮食方式对于维持正常肠道生理功能及系统代谢稳态至关重要,而长期不规律饮食(例如不吃早餐)会显著提升心血管疾病的发生风险,包括87%的心血管死亡风险及239%的中风风险(3)。为了探究上述双向营养供给失衡对肠道营养吸收的调影响,研究人员通过不同时间(0-24小时)的单一肠外营养供给后再口服进食,发现当肠外营养供给16小时后,通过进食供应的肠腔面营养特别是脂质在小肠中的吸收效率显著提高,而这与生活中不吃早餐所产生的空腹时间是类似的。因此,研究人员推测这种16小时空腹后再进食出现的脂质过度吸收可能与早餐进食窗口期的缺失诱发心血管疾病相关。为了更好地模拟人群中不吃早餐的进食习惯,研究人员开发了一套自动化远程控制的饲养装置,实现对小鼠饮食窗口期的精准控制。结果发现早餐进食窗口的缺失(而非午餐及晚餐)的喂养方式会引起肠细胞中包括胆固醇转运蛋白NPC1L1等脂质吸收基因的表达重编程,从而介导肠道对胆固醇的过度吸收进而加剧动脉粥样硬化的发展(与心脑血管疾病密切相关)。
王迪课题组长期围绕免疫代谢学的生理和病理调节开展系统性研究。在以往研究基础上,该工作运用多维度、可视化研究技术及自主设计的实验装置模型,系统性描绘了小肠双向营养供给环境的高分辨图谱及其对肠道和机体稳态调节的生理功能,将免疫代谢学研究扩展到营养吸收-宿主防御-代谢稳态的系统层面,揭示三者互调互稳的关键规律,并为临床上治疗TPN副作用及饮食紊乱介导的肠道免疫屏障受损及代谢紊乱提供了新的思路。
浙江大学基础医学院王迪教授、浙江大学爱丁堡大学联合学院刘琬璐研究员为本文通讯作者,浙江大学医学院/良渚实验室博士后章健,浙江大学爱丁堡大学联合学院在读博士生田若楠、中国科学院上海药物研究所刘佳研究员、袁杰博士为本文共同第一作者。该研究受到国家自然科学基金杰出青年基金、重点项目、浙江省重大项目等资助。
参考文献:
1. Marc Rhoads, J., and Wu, G. (2009). Glutamine, arginine, and leucine signaling in the
intestine. Amino Acids 37, 111-122. 10.1007/s00726-008-0225-4.
2. Shou J, Lappin J, Minnard EA, Daly JM. Total parenteral nutrition, bacterial translocation, and host immune function. American Journal of Surgery. 1994;167(1):145–50.
3. Rong, S, Snetselaar, L, Xu, G. et al. Association of Skipping Breakfast with Cardiovascular and All-Cause Mortality. JACC. 2019 Apr, 73 (16) 2025–2032.










