氯离子是人体中最丰富的阴离子,在多个生命过程中发挥重要作用。生物体中存在多种氯离子通道及转运蛋白,而氯离子/氢离子转运体ClC-3是其中的重要成员。此前的研究发现,生理上,ClC-3介导的离子转运能被ATP增强,但是不受ADP或者AMP的影响,从而使得ClC-3在一定程度上发挥能量感受器的作用;病理上,已经在多个病人上发现ClC-3上的点突变通过改变该转运体的功能,导致严重的神经退行性疾病。然而,关于ClC-3如何受到不同腺嘌呤核苷酸的差异化调节,以及点突变如何导致ClC-3的功能改变的原因尚不清楚。
2024年8月6日,来自浙江大学基础医学院生物物理系的杨帆团队与来自北京科学智能研究院、深势科技的温翰团队合作在《Nature Communications》杂志上发表了研究论文“Structural basis of adenine nucleotides regulation and neurodegenerative pathology in ClC-3 exchanger”,通过综合使用单颗粒冷冻电镜成像技术、单细胞膜片钳电生理记录和分子动力学计算模拟等多种生物物理技术,揭示了氯离子/氢离子转运体ClC-3充当细胞内能量感受器,受能量物质-腺嘌呤核苷酸(ATP、ADP、AMP)差异化调控的机制,并阐明了人类ClC-3点突变I607T介导的严重神经退行性疾病的机制。

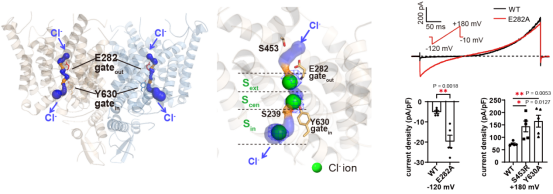
研究人员首先使用冷冻电镜技术,解析了小鼠ClC-3转运体处于无配体状态的高分辨三维结构,发现该转运体为同源二聚体,每个亚基具有单独的孔隙以转运离子。为了进一步明确ClC-3如何介导氯离子和氢离子的反向转运,研究人员发现了ClC-3的跨膜区具有分叉的氯离子和氢离子的转运路径,并在该路径上观察到了明确的球状电子云密度。通过结合点突变、膜片钳电生理的功能实验和分子动力学模拟,研究人员阐明了ClC-3转运氯离子和氢离子的机制。
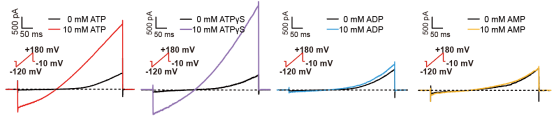
接下来,研究人员使用电生理全细胞膜片钳技术,发现了腺嘌呤核苷酸(ATP、ADP、AMP)差异化调控ClC-3的电流,其中ATP和非水解ATP类似物腺苷5'-(γ-硫代)-三磷酸(ATPγS)均能激活ClC-3,而ADP和AMP却不能。
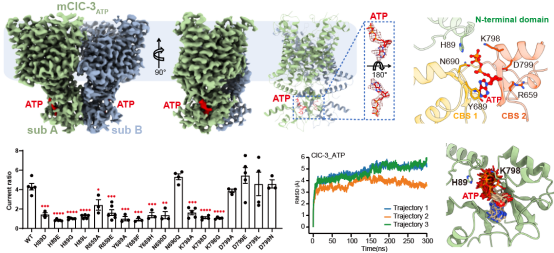
为阐明腺嘌呤核苷酸差异化调控ClC-3的机制,研究人员解析了ClC-3分别结合ATP、ADP、AMP的高分辨三维结构,发现了虽然ATP、ADP、AMP均结合至ClC-3的胞内cystathionine-beta-synthase(CBS)结构域,但分别诱导特定的构象变化。其中,ClC-3上位于腺嘌呤核苷酸结合口袋的H89和K798残基直接与ATP的γ磷酸相互作用,而ADP和AMP分子则远离这些氨基酸残基,因此研究人员猜测以上残基在腺嘌呤核苷酸差异性调控ClC-3的过程中起到关键作用。基于以上分析,研究人员结合电生理和基于分子动力学模拟的路径分析技术验证了以上猜想。
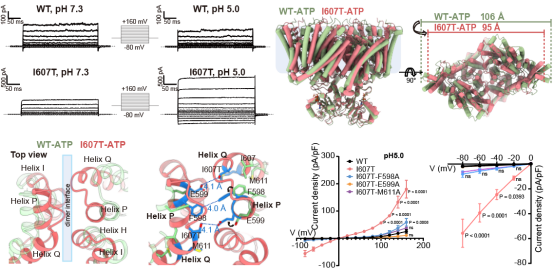
最后,为了揭示ClC-3人类神经退行性疾病突变体I607T引起该转运体功能增强的机制,研究人员解析了该突变体的三维结构。通过结构对比,发现了I607T突变体相较于WT,两个亚基之间发生了明显的内缩。为了验证这一结构变化带来的功能改变,研究人员在发生收缩的二聚体界面之处引入了点突变,打破两个亚基之间的互作,最终在膜片钳电生理实验中,观察到这些二聚体界面的点突变成功地逆转了I607T突变体的表型,从而明确了该二聚体界面是未来精准干预ClC-3点突变介导的神经退行性疾病的靶标结构域。
总之,通过综合使用多种生物物理学技术,研究人员不仅明确了ClC-3受不同腺嘌呤核苷酸差异化调控的分子机制,并且明确指出了针对ClC-3突变介导神经退行性疾病的药物发现的靶点区域。
浙江大学基础医学院生物物理学系博士研究生万杨卓群、郭爽爽、甄文轩和已毕业博士生徐丽臻为该工作的共同第一作者。浙江大学基础医学院生物物理学系的杨帆长聘副教授和北京科学智能研究院、深势科技的温翰博士为共同通讯作者。浙江大学基础医学院徐浩新、杨巍、张岩和郭江涛等多位老师为本研究提出了多项建设性建议。本研究得到了国家自然基金委和浙江省自然基金委的资助,浙江大学冷冻电镜中心为本研究提供了支持,本研究也得到了浙江大学公共技术平台刘双双等老师的大力支持。










