肝脏是体内脂质代谢的中枢,包括脂质摄取、脂肪生成、脂肪酸氧化和脂蛋白分泌。这些过程的功能障碍将导致许多代谢性疾病,如非酒精性脂肪肝(NAFLD)、肥胖、糖尿病和心血管疾病。随着西方饮食的全球流行,营养过剩逐渐成为NAFLD的主要致病因素。肝细胞可以感知饮食造成的肝脏脂质水平的变化,在靶基因启动子和增强子周围募集特异性转录因子,进而调控下游基因转录和信号转导。因此,了解这一过程中的调控机制对于探索NAFLD和相关代谢疾病的潜在治疗靶点至关重要。
表观遗传学通过感知营养信号和重塑转录网络,在代谢性疾病的发病机制中起着至关重要的作用。染色质重塑是表观遗传调控的关键机制,包括染色质组装、核小体编辑和染色质可及性的调节,而后者主要由SWI/SNF染色质重塑复合体完成。它们依靠ATP水解产生的能量重新定位核小体,使转录因子更容易到达染色质上的结合位点,从而调节基因表达。SWI/SNF复合体的关键亚基BAF60a,b和c在介导核心复合体与转录因子之间的相互作用中起着至关重要的“桥梁”作用。在过去的十五年中,孟卓贤课题组长期关注SWI/SMF染色质重塑复合物在代谢稳态中的作用和机制,并揭示了BAF60a,b,c在不同代谢组织中的功能。在肝脏中,BAF60a和BAF60c已被证明是肝脏脂肪酸氧化、胆汁酸代谢和胰岛素诱导的脂肪生成的有效调控因子(Cell Metab 2008, Cell Rep 2015,Mol Cell 2013)。然而,关于BAF60b在代谢调节中的作用,特别是在肝脏脂质代谢中的作用,仍知之甚少。
2024年7月24日,浙江大学基础医学院/附属第二医院孟卓贤研究员团队在Diabetes杂志在线发表 “Identification of BAF60b as a chromatin remodeling checkpoint of diet-induced fatty liver disease” 的研究论文,揭示肝脏BAF60b是高脂饮食重塑肝脏代谢转录程序的关键因子,是治疗NAFLD的潜在新靶点,并阐释了其中的机制。

在本研究中,研究人员发现高脂饮食(HFD)短期喂养野生型C57BL/6J小鼠肝脏BAF60b蛋白的表达出现显著上调的变化,提示肝脏BAF60b是SWI/SNF染色质重塑复合体中的脂质敏感亚基。随着HFD喂养时间的延长,BAF60b的表达逐渐下降,体外实验结果也证实了这样的变化,并提出HFD中的棕榈酸(PA)是导致BAF60b表达变化的主要脂质。进而,研究人员发现NAFLD小鼠肝脏样本中BAF60b的表达显著低于对照小鼠,除此之外,临床肝脏样本的结果也显示BAF60b的表达和肝脏脂肪含量呈显著的负相关关系,推测BAF60b可能在肝脂肪变性和NAFLD进展中起关键作用。
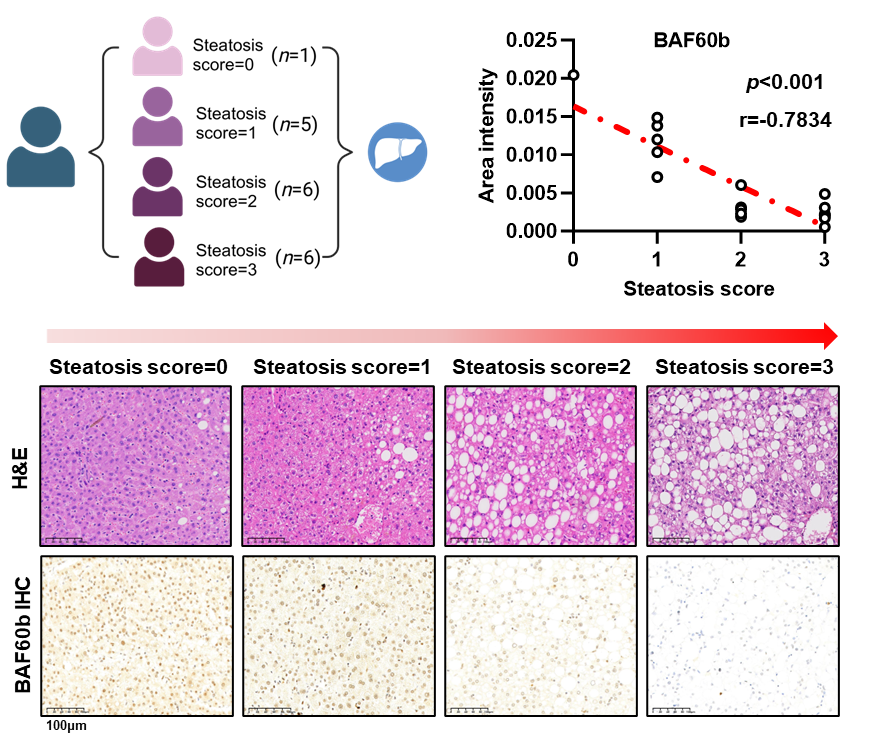
图1 人肝脏BAF60b的表达和肝脏脂肪含量呈显著的负相关关系
为此,研究人员构建了肝脏特异性BAF60b敲除(BbLKO)和过表达(BbLKI)小鼠模型,结果显示BbLKO显著加重了HFD诱导的脂肪肝,而BbLKI显著减轻HFD诱导的肥胖和脂肪肝。为进一步研究BAF60b调控肝脏脂质代谢的机制,研究人员对BbLKO和BbLKI小鼠的肝组织进行了RNA-Seq测序和分析,发现BAF60b肝脏敲除和过表达均伴随着PPARγ表达的显著变化。通过肝脏ATAC-Seq基序分析和体内外验证实验,研究人员证实了BAF60b主要通过与CCAAT/增强子结合蛋白β (C/EBPβ)相互作用抑制PPARγ基因的表达,进而影响肝脏脂质积累。
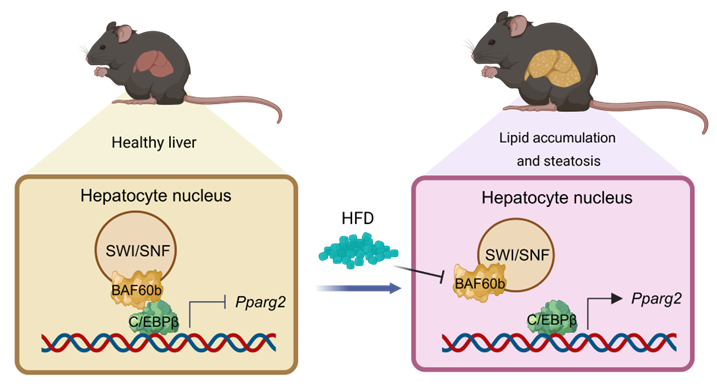
图2 机制示意图
在正常生理条件下,BAF60b抑制肝脏C/EBPβ介导的Pparg2基因诱导和肝脏脂质积累。然而,长期饲喂HFD导致BAF60b的表达下降,从而导致C/EBPβ介导的Pparg2表达过度激活、肝脏脂质积累和NAFLD进展。
这一研究主要揭示了肝脏BAF60b是一种脂质传感器,将营养信号与肝脏脂质稳态联系起来,并进一步揭示了PPARγ是BAF60b介导的染色质重塑和肝脏脂质代谢转录重编程的重要下游效应物。因此,本研究认为染色质重塑因子BAF60b主要通过参与C/EBPβ/PPARγ轴来控制肝脏脂质感知、积累进而影响NAFLD的进展。
浙江大学基础医学院/附属第二医院孟卓贤研究员为论文最后通讯作者,孟卓贤团队成员钟婧、姬秀雨、赵亚丽、贾一何为论文共同第一作者。本课题得到中国科学院上海营养与健康研究所李于研究员、浙江大学医学院附属湖州医院王伟洪主任医师的大力支持。本研究受到科技部重大研发计划、国家自然科学基金重大研究计划、国家优秀青年自然科学基金、国家自然科学基金、浙江省自然科学基金、浙江大学基础医学院附属湖州中心医院预研基金的支持。










