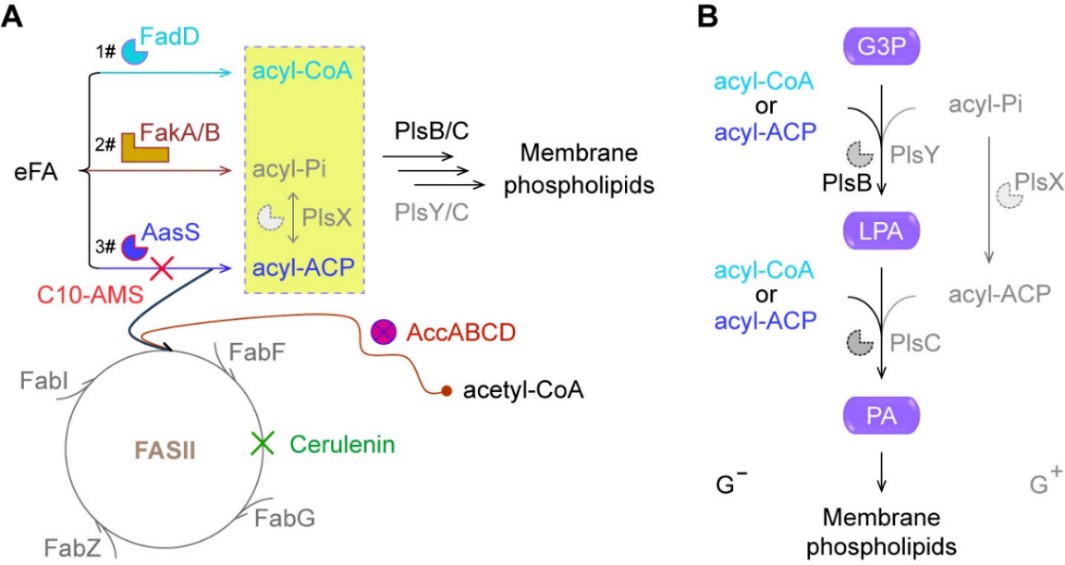
细菌耐药性已成为全球的严峻挑战,严重威胁人类健康。细菌通过多种机制对抗抗生素,使得一些传统药物失去了效力。为了应对这一难题,科学家们不断探索新的解决方法。脂肪酸是细胞膜磷脂的重要组成部分,对于细菌的生存至关重要。细菌经II型脂肪酸合成途径(FAS II)合成其生存必需的脂肪酸,通过靶向FAS II来阻断脂肪酸的合成从而杀死细菌是一类抗生素作用机理。然而,细菌亦并非坐以待毙。部分细菌可通过acyl-ACP合成酶(AasS)直接摄取外源脂肪酸,从而绕过FAS II途径。这样一来,靶向FAS II的抗生素就面临失效的风险。细菌的这一狡猾策略,让科学家们倍感棘手。但科学家们没有轻易认输,继续寻找破解细菌耐药性的妙招。近期,一种名为C10-AMS的化合物被发现,它可以抑制AasS的活性,从而降低甚至阻断细菌摄取外源脂肪酸的能力。这意味着,即使细菌绕过了FAS II途径,C10-AMS也能有效地抑制其生存。这一发现为抗菌研究领域注入了一剂强心针。然而,C10-AMS作为抑制剂的具体作用原理还有待进一步研究。
2024年7月15日,浙江大学基础医学院冯友军课题组与公共卫生学院周春课题组、浙江大学医学院冷冻电镜中心张兴携手合作,在病原微生物研究领域知名期刊《PLOS Pathogens》发表题为《An inhibitory mechanism of AasS, an exogenous fatty acid scavenger: Implications for re-sensitization of FAS II antimicrobials》的研究长文,揭示了AasS抑制剂C10-AMS发挥功能的结构基础及生化机制。通过一系列实验,研究团队发现C10-AMS能够与AasS有效结合,并阻碍不同长度的脂肪酰基底物进入,进而阻断AasS介导的脂肪酸摄取途径。利用冷冻电镜单颗粒技术,研究团队还解析了AasS/C10-AMS抑制剂的复合物结构,发现C10-AMS使AasS由“开放构象” 转为“封闭构象”,大大削弱了AasS的活性。这一发现如同揭开了细菌的“防御盾”,让科学家们看清了它的弱点,为开发新的抗菌策略提供了宝贵的信息。通过抑制AasS,可以让靶向FAS II的抗生素重新发挥作用,帮助克服细菌耐药性的问题。未来,C10-AMS及其衍生物有望与FAS II抑制剂联合使用,形成“双剑合璧”的疗法,更有效地对抗部分细菌的感染。

脂肪酸对于生命体来说不可或缺,II型脂肪酸合成途径(FASII)对细菌的存活极为关键,这也是靶向FASII的抗生素发挥作用的重要机制。然而研究发现,几乎所有的细菌都有一套能够不利用FASII途径合成其存活必需的脂肪酸的机制,而是通过吸收外源脂肪酸来建立它们的膜磷脂(图1)。不同细菌演化出3种脂肪酸摄取机制,与已知的两个系统酰基-CoA合成酶FadD和FakA/B激酶通路不同,AasS作为酰基-ACP合成酶代表了第三种eFA利用机制,它可以绕过FAS II途径。鉴于AasS获取eFA的途径可绕过FAS II的抑制剂(例如Cerulenin),因此利用AasS抑制剂C10-AMS来逆转FAS II这一通路似乎是可行的(图1)。
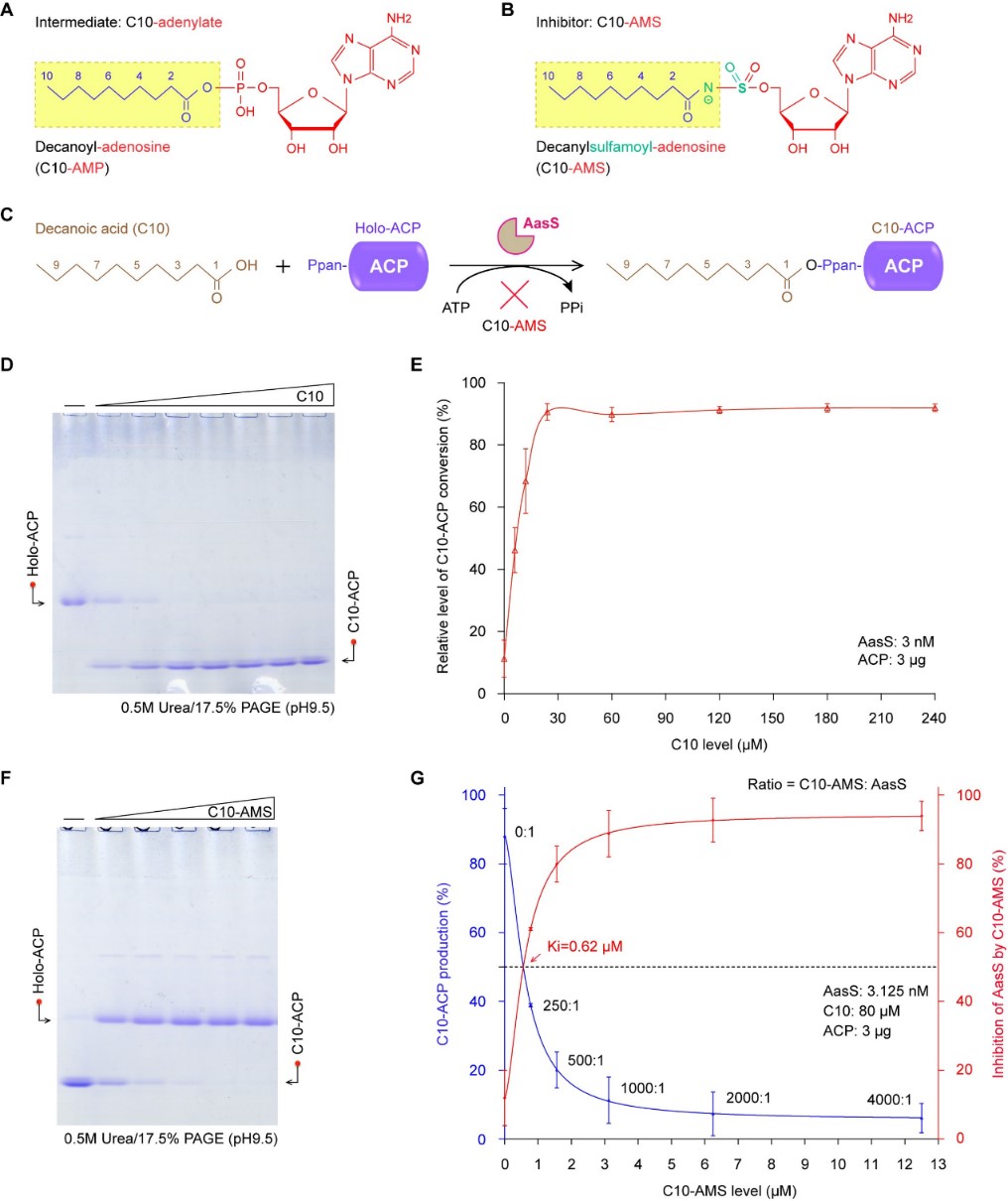
在生化机制方面,通过体内外酶活实验,发现C10-AMS与AasS的结合能阻碍不同长度的脂肪酰基底物的进入,揭示其具有阻断AasS介导的外源脂肪酸摄取能力(图2),证明C10-AMS是一种有效的AasS抑制剂,其抑制剂强度Ki值仅约0.6 μM(图3)。值得一提的是,该研究还利用冷冻电镜单颗粒技术,揭示了AasS与抑制剂C10-AMS结合的神秘面纱。除AasS独立轮廓外(2.53 Å),该研究获得了AasS与抑制剂C10-AMS的复合物结构(2.33 Å)以其与反应中间体C10-AMP的复合物结构(2.19 Å)。结构比对结果清晰地表明,AasS存在两种不同的构象:开放构象和封闭构象。通常情况下,AasS以开放构象结合其天然底物。然而,当抑制剂C10-AMS与AasS结合时,它诱导AasS从开放构象转变为紧密的封闭构象。这一结构变化抑制了AasS与其天然底物的结合,从而有效地抑制了AasS作为Acyl-ACP合成酶的催化活性(图4)。为了深入理解C10-AMS与AasS之间的相互作用,研究团队开展了一系列突变实验,成功鉴定了AasS结合C10-AMS的关键残基。这些关键性的发现,不仅为C10-AMS作为AasS抑制剂的角色提供了有力支撑,也为未来抗菌药物的设计和开发提供了详尽的结构信息。
综上所述,该研究结果为抑制AasS利用外源脂肪酸来逆转FASII通路提供了理论证据,为开发新的抗菌策略提供了潜在的靶点,尤其是由C10-AMS及其衍生物与某些FAS II抑制剂联合组成的双重疗法。
冯友军课题组长期聚焦“细菌脂代谢与耐药/致病性的机制”研究,发表重要研究论文60余篇,累计引用11600余次(h-index: 53)。该研究工作先后获得了国家自然科学基金委的耐药重点专项(32141001)、重点项目(31830001)以及杰青项目(32125003)的联合资助。浙江大学基础医学院冯友军课题组博士生黄昊旻、浙江大学医学院冷冻电镜中心常圣海博士和西北工业大学崔涛副教授系该研究论文的共同第一作者。浙江大学基础医学院冯友军教授、公共卫生学院周春研究员与浙江大学医学院冷冻电镜中心张兴教授担任该研究论文的共同通讯作者。










