RNA 5-甲基胞嘧啶(m5C)修饰是一种保守的转录后修饰,广泛分布在rRNA、tRNA和mRNA上。mRNA上的m5C修饰主要由NSUN2和NSUN6等甲基转移酶催化产生,并且可以被TET家族蛋白和ALKBH1进一步氧化到hm5C,f5C和ca5C。RNA m5C修饰可以被特定的结合蛋白所识别进而参与基因表达调控,如近年来国家生物信息中心杨运桂团队在RNA m5C修饰研究中取得了系列突破性成果,报道了包括ALYREF, YBX1, YBX2和SRSF2在内的多个结合蛋白及其调控功能,极大地推动了对于RNA m5C修饰生物学功能的理解。
对于RNA m5C修饰功能的探究依赖于灵敏精准的检测技术。目前RNA m5C修饰检测主要依赖于亚硫酸氢盐测序(bisulfite sequencing,BS-seq),在BS-seq中未修饰的胞嘧啶(C)被转变为尿嘧啶(U),而m5C保持不变,因此通过检测未转变C即可实现对于m5C修饰的鉴定。虽然BS-seq操作简单便捷,并且可以实现单碱基分辨率m5C修饰的定量检测,但是其存在三个主要不足之处:1)间接检测m5C,依赖于未修饰C的高效转换,转换不完全可能会导致假阳性;2)反应条件苛刻,导致RNA降解,限制低起始量样本和低丰度RNA的检测;3)C转变为U后序列复杂度降低,影响比对准确度,限制低序列复杂度RNA 上m5C的检测。尽管一系列优化措施如使用ACT三元碱基随机引物提高检测精准度与灵敏度、优化分析流程、利用无修饰RNA文库校正和 Ultrafast BS反应条件提高转换效率等,显著提升了BS-seq的检测精准度,但由于mRNA m5C修饰水平较低(中位数约为20%以下),对于依赖间接检测的BS-seq,低复杂度序列以及低修饰比例位点的灵敏检测仍是挑战。虽然目前已有多种不依赖亚硫酸氢盐的RNA m5C检测方法被报道,但是这些方法各有局限,均无法实现全转录组水平RNA m5C修饰单碱基分辨率无偏检测。
2024年7月12日,浙江大学基础医学院李笑雨研究员联合北京大学生命科学学院伊成器教授在Molecular Cell发表了题为Base-resolution m5C profiling across the mammalian transcriptome by bisulfite-free enzyme-assisted chemical labeling approach的研究论文,该研究开发了一种不依赖于亚硫酸氢盐的检测新技术,m5C-TAC-seq(m5C detection strategy enabled by TET-assisted chemical labeling),实现了全转录组水平m5C位点单碱基分辨率的精准、灵敏检测。

这项技术的核心原理是将酶促反应与化学标记相结合,利用优化后的TET酶促反应将RNA m5C氧化至f5C,进一步使用叠氮茚二酮(AI)对于氧化产生的f5C进行特异性标记,标记产物不仅可以产生C-to-T的转变,并且还可以通过点击化学反应进行富集,从而实现对于m5C修饰单碱基分辨率的直接检测(图1A)。这一直接检测的特性使其能够灵敏检测修饰比例低至2.5%的位点(图1B)。此外该方法还具有反应条件温和、不影响转录组碱基组成的特点,因此可以应用于低丰度和低序列复杂度的转录本。同时,结合multiplexing文库构建策略,不仅可以减少样品之间的技术误差,并且能够实现m5C修饰的半定量检测。
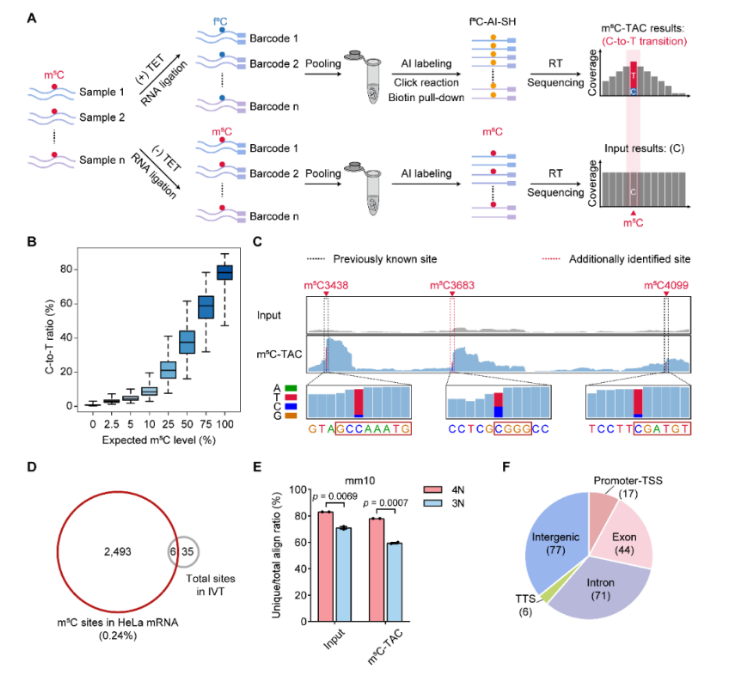
图1:m5C-TAC-seq可以实现单碱基分辨率m5C位点检测。A. m5C-TAC-seq原理及流程图;B. m5C-TAC-seq计算的C-to-T转化率与m5C修饰比例呈现正相关;C. m5C-TAC-seq可以实现对于rRNA已知位点与未知位点的灵敏检测;D. 未修饰HeLa转录组文库对照分析提示2,499个m5C位点中只有6个位假阳性位点;E. 四元碱基组成大大提高了比对准确度;F. caRNA上m5C修饰位点分布。
为了评估m5C-TAC-seq的灵敏性和准确性,研究人员首先将其应用于rRNA和tRNA上。在rRNA上,m5C-TAC-seq不仅能够精准检测已知的高m5C修饰位点,并且还鉴定了一个新的低修饰位点m5C3683及其修饰酶(图1C),验证了m5C-TAC-seq的灵敏度。此外,对于具有复杂二级结构且序列复杂度较低的tRNA,m5C-TAC-seq不仅能够鉴定所有已报道位点及其修饰酶,并且由于保留了四元碱基组成使得其可以实现对不同tRNA isodecoder的精准检测。利用m5C-TAC-seq,研究人员绘制了HeLa、HEK293T和mESC的单碱基分辨率m5C修饰图谱,分别鉴定了2499、765和664个m5C位点,并利用无修饰转录组文库进行对照分析验证了这些位点的可靠性(图1D)。更为重要的是,鉴定了绝大多数m5C位点的甲基转移酶,进一步确认了这些位点的准确性。此外,与BS-seq相比,m5C-TAC-seq在低修饰位点的检测上也表现出高精度和高灵敏度,提示其直接检测策略的鲁棒性。
进一步研究发现,除了已知的NSUN2和NSUN6,rRNA甲基转移酶NSUN5也可以作用于mRNA,这一发现与近期中山大学张锐团队开发的高灵敏motif分析工具iMVP在mRNA上鉴定到的NSUN5 motif一致。此外,利用m5C-TAC-seq,研究人员还发现在mESC的分化过程中,大部分mRNA上m5C位点呈现甲基化水平下调趋势,并且富集在细胞周期及细胞分裂相关通路的转录本上,提示了m5C修饰可能参与到mESC分化过程中。得益于温和的反应条件及对碱基组成的保留(图1E),m5C-TAC-seq实现了对含有大量低复杂度序列的chromatin-associated RNA(caRNA)上m5C位点的鉴定(图1F),提示了四元碱基的保留对于低复杂度序列上m5C修饰检测的重要性。
综上所述,该研究开发了直接检测m5C修饰的新技术m5C-TAC-seq,并展示了m5C-TAC-seq技术高灵敏、高精准的检测特性。m5C-TAC-seq不仅可以应用于包括低丰度、低序列复杂度在内的多种类型RNA和低修饰比例m5C位点的检测,并且可以实现在多种生物学过程中m5C修饰的动态检测,将有助于理解和推动RNA m5C修饰生物学功能的探究。
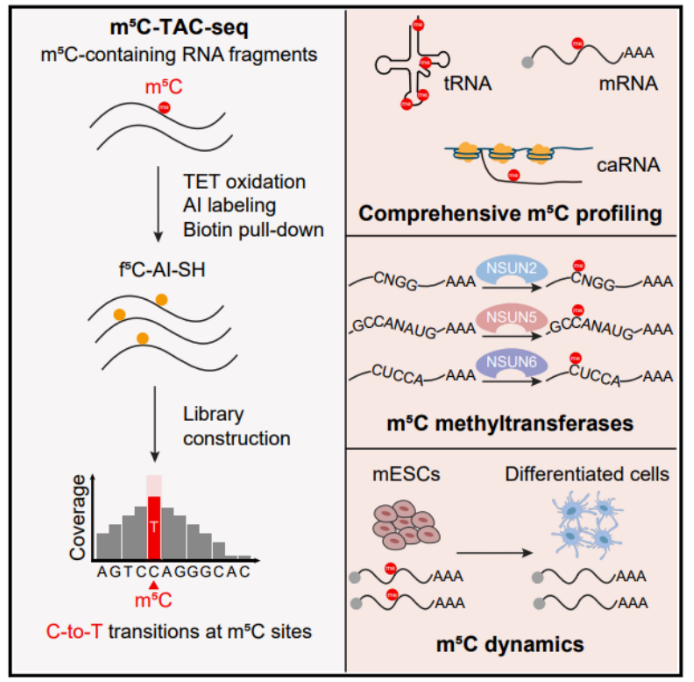
图2:m5C-TAC-seq可以应用于多种类型RNA以及生物学过程中m5C修饰位点的动态检测。
浙江大学医学院博士研究生卢亮、北京大学生科院张晓婷博士、浙江大学医学院周悦南博士和施佐堃博士为共同第一作者。浙江大学医学院李笑雨研究员和北京大学伊成器教授为本论文的共同通讯作者。浙江大学王青青教授、尹亚飞研究员、熊旭深研究员和冯钰研究员,中山大学杨建华教授,国家生物信息中心杨莹研究员和山东大学孙磊研究员对本研究提供了重要的帮助和讨论支持。
浙江大学医学院李笑雨研究员主要研究方向为RNA修饰检测技术的开发及小非编码RNA上修饰功能的探究,常年招收博士后和科研助理,欢迎有兴趣的同学投递简历,课题组主页:https://person.zju.edu.cn/lixiaoyu
原文链接:https://doi.org/10.1016/j.molcel.2024.06.021










