自噬(Autophagy)是真核细胞中高度保守的细胞内降解过程。当细胞受到内外环境压力时,胞内冗余的蛋白质、受损的细胞器或异常聚集体被包裹到自噬体中并转运至溶酶体/液泡进行降解。研究表明,自噬的发生同时受到细胞物质代谢和能量代谢的调控。对于物质代谢调控的自噬,2016年诺贝尔生理或医学奖获得者-日本东京工业大学教授大隅良典做出了突出贡献。然而,对于能量代谢调控的自噬,我们的认知则要少的多。其中的关键步骤-细胞如何感知并响应能量应激启动自噬发生的机制仍不清楚;能量感受器Snf1/AMPK如何磷酸化并激活自噬发生必需蛋白激酶Atg1/ULK1启动自噬发生的机制仍未被阐明。
2024年7月9日, 浙江大学基础医学院易聪课题组在《Journal of Cell Biology》杂志在线发表了题为“Ca2+-triggered Atg11-Bmh1/2-Snf1 complex assembly initiates autophagy upon glucose starvation”的研究论文。该研究发现Ca2+作为一个关键的触发信号,将环境感知与葡萄糖饥饿诱导的自噬起始复合物的形成联系起来,提出了钙信号触发的Atg11-Bmh1/2-Snf1复合物的组装通过控制Snf1介导的Atg1激活来响应能量应激启动自噬发生的新机制。

从机制上讲,葡萄糖饥饿造成的能量应激引发液泡钙释放到细胞质中,导致细胞质钙水平的显著升高,从而触发钙/钙调蛋白激酶Rck2的激活。随后,激活的Rck2磷酸化自噬相关蛋白Atg11, 进而增强了Atg11与磷酸化结合蛋白Bmh1和Bmh2的结合。进一步地研究发现,Bmh1和Bmh2蛋白与Snf1-Sip1-Snf4复合物在葡萄糖饥饿情况下互作显著增加,导致液泡膜定位的Snf1(能量感受器AMPK在酵母中的同源物)被招募到自噬前体并激活Atg1,从而启动自噬。此外,我们还发现Glc7(一种蛋白磷酸酶)是介导Bmh1/2与Snf1复合物互作的关键调控因子。因此,我们提出,钙触发的Atg11-Bmh1/2-Snf1复合物组装通过控制Snf1介导的Atg1激活来响应葡萄糖饥饿,从而启动自噬。这项研究受到了审稿人的高度评价,均认为此研究极大的促进了我们对能量应激诱导自噬发生的认知,系统阐明了细胞如何感知并响应葡萄糖饥饿诱导自噬发生的调控机制。
从机制上讲,葡萄糖饥饿造成的能量应激引发液泡钙释放到细胞质中,导致细胞质钙水平的显著升高,从而触发钙/钙调蛋白激酶Rck2的激活。随后,激活的Rck2磷酸化自噬相关蛋白Atg11, 进而增强了Atg11与磷酸化结合蛋白Bmh1和Bmh2的结合。进一步地研究发现,Bmh1和Bmh2蛋白与Snf1-Sip1-Snf4复合物在葡萄糖饥饿情况下互作显著增加,导致液泡膜定位的Snf1(能量感受器AMPK在酵母中的同源物)被招募到自噬前体并激活Atg1,从而启动自噬。此外,我们还发现Glc7(一种蛋白磷酸酶)是介导Bmh1/2与Snf1复合物互作的关键调控因子。因此,我们提出,钙触发的Atg11-Bmh1/2-Snf1复合物组装通过控制Snf1介导的Atg1激活来响应葡萄糖饥饿,从而启动自噬。这项研究受到了审稿人的高度评价,均认为此研究极大的促进了我们对能量应激诱导自噬发生的认知,系统阐明了细胞如何感知并响应葡萄糖饥饿诱导自噬发生的调控机制。
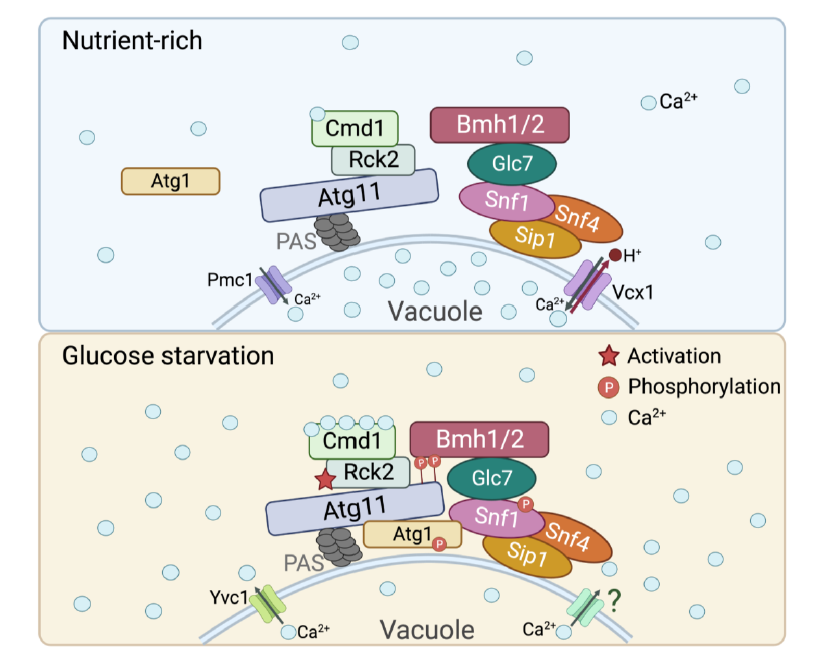
模式图:钙触发的Atg11-Bmh1/2-Snf1复合物组装启动葡萄糖饥饿下的自噬发生
浙江大学基础医学院长聘副教授易聪为本文最后通讯作者,广州医科大学冯杜教授和华中师范大学仝晶晶教授为本文共同通讯作者。易聪课题组成员姚伟静、陈颖聪、张毅(以前为冯杜教授课题组研究生)和仝晶晶教授课题组成员钟书为本文的共同第一作者。该课题的开展得到了刘伟教授、周龙研究员,浙江理工大学王毅刚教授,湖州师范学院吴酬飞教授和张立钦教授的大力支持。该研究工作受到科技部、基金委、浙江省自然科学基金委杰青项目等经费资助。










