白血病是一种造血系统恶性肿瘤,发病率和死亡率逐渐增高,严重威胁人们的健康及生命。当前临床一线的治疗策略仍然以化疗为主,包括经典的化疗3+7方案(蒽环类药物治疗3天后阿糖胞苷治疗7天)及最新报道的DAV(多柔比星,阿糖胞苷,维奈托克)方案等。但化疗无法完全清除残留的肿瘤细胞且具有严重的副作用。在化疗取得缓解的窗口期进行造血干细胞移植是治疗白血病的重要策略。但是HSCT通常面临人类白细胞抗原(HLA)配型困难及移植物抗宿主病(GVHD)的问题,并且移植后通常面临复发的风险。近年来,免疫疗法如免疫检查点抑制剂ICI疗法和过继性细胞疗法如嵌合抗原受体T细胞(Car-T)疗法在白血病治疗中表现出极大的前景。Car-T细胞疗法在B细胞白血病中取得良好进展,但仍有部分患者对免疫疗法不产生响应并在治疗后复发。因此,白血病需要探究新的治疗策略。骨髓是白血病细胞形成并积累的首要器官,靶向骨髓进行药物递送是治疗白血病的有前景的策略。
纳米颗粒在药物靶向递送中具有极大的优势。脂质体纳米颗粒(LNP)载药系统在疫苗与癌症治疗中广泛应用与研究。但未经修饰的脂质体载药纳米颗粒靶向性较差,且体内循环时间短易被快速代谢清除。近年来研究表明,细胞膜包覆纳米颗粒具有免疫原性低,体内循环时间长等优点,且细胞膜自带的组织特异性抗原或归巢分子使其具有良好的器官靶向特性。最近的研究表明,通过将脂质体和间充质干细胞(MSC)细胞膜融合制备的工程化脂质纳米颗粒,可以增加脂质纳米颗粒的器官靶向性并显著提高疾病治疗效果。
2024年7月7日,浙江大学基础医学院/良渚实验室钱鹏旭课题组联合浙江大学药学院/金华研究院高建青团队在Nature Communications杂志在线发表了题为“Hematopoietic stem and progenitor cell membrane-coated vesicles for bone marrow-targeted leukaemia drug delivery”的研究论文,首次报道了将造血干祖细胞膜与脂质体结合制备载药纳米颗粒,利用造血干祖细胞(HSPCs)天然归巢到骨髓的特性,实现靶向骨髓递送白血病药物。

该研究开发了一种来源于造血干祖细胞(HSPC)的细胞膜仿生脂质体囊泡HSPC-Lipo,用于靶向递送药物到骨髓并消除白血病细胞。通过融合HSPC细胞膜和脂质体制备细胞膜包被的仿生脂质体HSPC-Lipo。该HSPC-Lipo通过表面的CD44与骨髓中透明质酸相互作用靶向骨髓微环境,并在白血病小鼠骨髓中大量聚集。此外,蛋白质谱测序结果表明,该仿生脂质体通过细胞间黏附分子-1(ICAM-1)/整合素β2(ITGB2)相互作用对白血病细胞表现出特异性的亲和力。进一步体内外实验证实,携带化疗药物阿糖胞苷(Ara-C)的仿生脂质体Ara-C@HSPC-Lipo能显著抑制白血病细胞增殖,诱导凋亡和分化,清除白血病干细胞。在机制上,转录组测序RNA-seq显示Ara-C@HSPC-Lipo治疗诱导细胞凋亡和分化,并减少细胞周期和致癌相关通路信号。最后,本研究检测了该仿生脂质体具有良好的生物安全性。
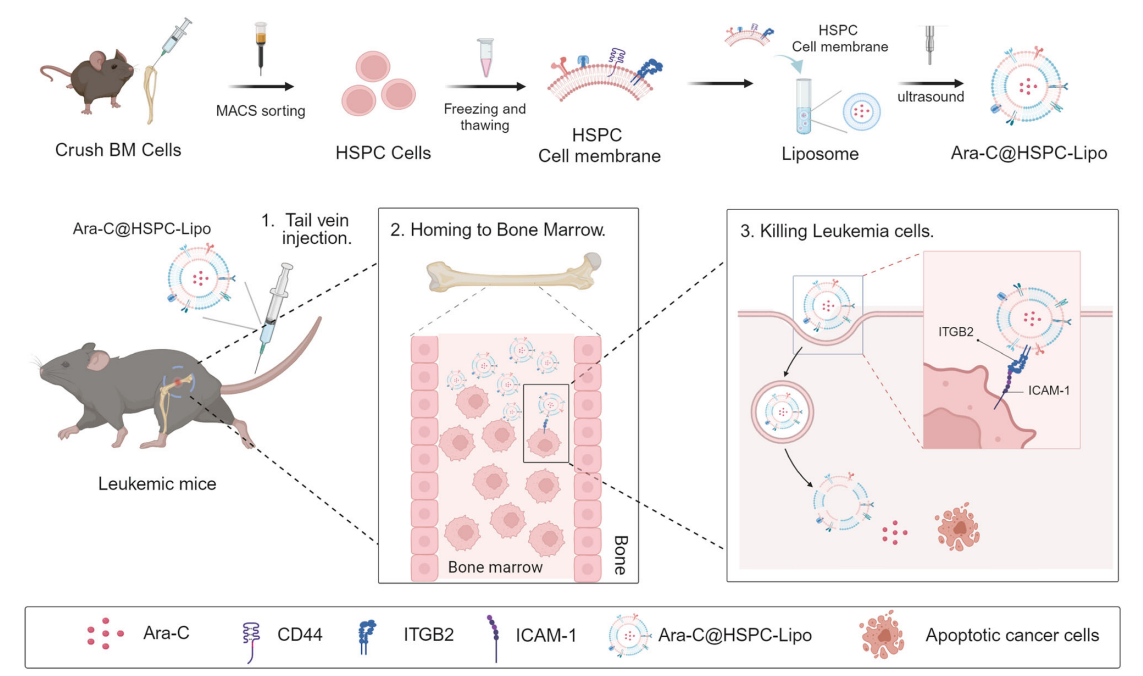
综上所述,本研究通过将HSPC细胞膜与脂质体相融合,制备出靶向骨髓的仿生脂质纳米颗粒HSPC-Lipo。在白血病小鼠模型中,该纳米颗粒可以显著增加在骨髓中的富集。装载白血病化疗药物阿糖胞苷(Ara-C)后,该纳米颗粒对白血病细胞的毒性显著增强,且白血病干细胞比例显著降低,细胞分化程度显著提高。动物实验中,该纳米制剂处理后白血病小鼠生存期显著延长。通过对该纳米颗粒进行蛋白质谱测序发现,该纳米颗粒表面归巢与粘附相关分子CD44及ITGB2在介导骨髓与白血病细胞靶向中起重要作用。本研究为治疗骨髓来源的肿瘤纳米药物递送提供了参考,并为纳米药物的靶向递送设计提供了参考。
浙江大学基础医学院博士生李金鑫、浙江大学药学院/金华研究院博士后吴宏辉、浙江大学基础医学院博士生俞泽斌,浙江大学基础医学院博士后王琪炜和浙江大学医学院附属第一医院科研助理曾欣为此工作的共同第一作者。浙江大学基础医学院/良渚实验室钱鹏旭研究员和浙江大学药学院/金华研究院高建青教授为通讯作者。感谢浙江大学医学院和良渚实验室公共技术平台及动物中心为本工作提供了大力支持。










