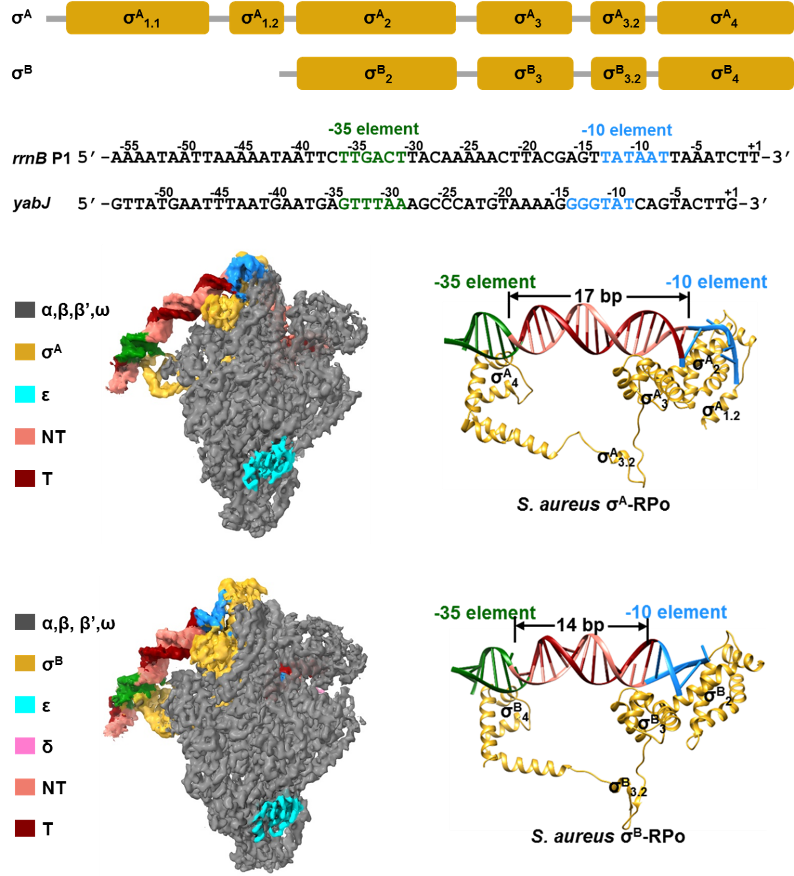
RNA聚合酶是催化基因转录的蛋白质机器,也是抗菌药物利福平的分子靶标。RNA聚合酶只有和σ因子形成全酶以后才能识别启动子序列并起始转录。金黄色葡萄球菌有4个不同的σ因子,其中σA负责正常生长时大部分基因的转录,σB则特异性起始应激基因的转录。虽然σA和σB具有一定的同源性,但是其识别的启动子截然不同。σA识别的-35区和-10区的保守序列分别是TTGACA和TATAAT,σB识别的-35区和-10区的保守序列分别是GTTTWW和GGGWAW(W代表A或T)。更重要的是σA识别的-35区和-10区之间的间隔是17个碱基对,而σB识别的-35区和-10区之间的间隔是14个碱基对。目前尚无金黄色葡萄球菌RNA聚合酶的高分辨率结构,也不清楚σA和σB识别相应启动子的结构基础。
2024年6月6日,浙江大学基础医学院冯钰团队在《Nature Communications》在线发表了题为“Structural basis of promoter recognition by Staphylococcus aureus RNA polymerase”的研究论文。该研究首次解析金黄色葡萄球菌RNA聚合酶的高分辨率结构,揭示了σA和σB识别相应启动子并起始转录的结构机理。

在这项研究中,作者成功表达和纯化了金黄色葡萄球菌的RNA聚合酶核心酶,并用纯化的核心酶和σA、σB组装成全酶。体外转录实验证实全酶可以起始相应启动子的转录,凝胶迁移实验显示含有σA的全酶可以和启动子rrnB P1形成稳定的复合物σA-RPo,含有σB的全酶可以和启动子yabJ形成稳定的复合物σB-RPo。随后,作者利用冷冻电镜单颗粒重构的方法分别解析了两个复合物的结构。结构分析显示,σA通过σ2识别-10区,σB则通过σ3和σ2共同识别-10区,这就解释了为什么σA和σB识别的启动子截然不同。
利福平可以治疗金黄色葡萄球菌引起的假体周围感染,但是临床使用过程中极易产生耐药菌株。基因测序显示所有耐药菌株均通过突变RNA聚合酶获得耐药性。为此,作者搭建了利福平和金黄色葡萄球菌RNA聚合酶的复合物结构模型,模型显示利福平和突变位点具有氢键相互作用,很好地解释了突变耐药的原因,并有助于设计化合物克服利福平耐药问题。
浙江大学基础医学院博士后元玲刚、博士研究生柳清扬和徐丽巧为该研究的共同第一作者,浙江大学基础医学院冯钰研究员为该研究的通讯作者。该研究的冷冻电镜工作全部在浙江大学冷冻电镜中心完成,也得到了浙江大学医学院公共技术平台的支持。










