近年来,免疫检查点阻断(ICI)技术,特别是针对PD-1/PD-L1通路的疗法,已在癌症治疗中展现出巨大的潜力。然而,其疗效常常面临多种耐药机制带来的复杂挑战。PD-L1可发生内化过程,大部分内化的PD-L1能通过内体循环途径再次返回至细胞膜上,成为肿瘤对ICI治疗产生抗性的关键机制。如何使得内化的PD-L1蛋白直接降解,是降低肿瘤免疫抑制,增强ICI疗效的重要途径。
一部分内化的PD-L1可经由溶酶体介导降解。已有研究显示CMTM6在PD-L1重新定位至细胞膜的过程中发挥着关键作用,CMTM6的耗竭可以显著促进PD-L1通过溶酶体途径降解。然而,关于PD-L1通过溶酶体降解的具体机制,我们仍知之甚少。因此,深入探究PD-L1的溶酶体降解机制及其调控蛋白,不仅有助于我们更全面地理解免疫治疗的作用机制,还可为提升免疫治疗的效果,优化ICI疗法提供全新的思路和策略。这是一个既具挑战又充满希望的研究领域。
2024年5月18日,浙江大学基础医学院/良渚实验室夏宏光教授团队和浙江大学医学院/良渚实验室王东睿研究员合作在《Nature Communications》杂志上在线发表了其最新研究成果,揭示了Hsc70蛋白抑制肿瘤免疫治疗耐药的新机制。研究团队发现,通过增强Hsc70的表达,可以显著促进PD-L1通过溶酶体降解,削弱PD-L1通过内体循环返回细胞膜。这一发现不仅为理解抗肿瘤免疫提供了新的视角,也为改善免疫检查点抑制剂(ICI)耐药问题提供了新的思路。

PD-L1是一种细胞膜蛋白,同时其表达也存在细胞膜与细胞质间的循环过程。而Hsc70蛋白的介入,打破了这一平衡,通过促进PD-L1的溶酶体降解,降低了PD-L1在细胞膜上的表达,进而削弱肿瘤对免疫细胞的抑制作用,增强了抗肿瘤免疫的效果。更为重要的是,研究团队还发现,通过增强Hsc70的表达,可以进一步增强PD-L1(aPD-L1)和CTLA4(aCTLA4)免疫治疗药物的抗肿瘤效果。这一发现为临床上开发更安全有效的免疫治疗药物提供了新的策略。
PD-1/PD-L1免疫检查点阻断(ICI)作为癌症治疗领域的一种重要策略,为众多患者带来了希望,但仍面临大部分患者产生耐药性的挑战。针对此问题,不少研究人员提出了新的方法,即通过促进PD-L1的降解来克服ICI治疗的耐药性。在以往的研究中,关于PD-L1降解的探索多集中于蛋白酶体降解途径,而内体-溶酶体途径的降解机制则鲜有涉及,夏宏光/王东睿团队的最新研究为我们提供了新的视角。他们的研究结果提示,通过增强Hsc70水平,可以有效地促进PD-L1通过内体-溶酶体途径进行降解。其进一步研究提示,Hsc70与CMTM6在结合PD-L1上形成了竞争关系,这种竞争促进了PD-L1的溶酶体降解,显著减少了PD-L1重新循环回细胞膜的机会。这一变化直接降低了肿瘤细胞上PD-L1与T细胞PD-1的相互作用,进而重新激活了T细胞介导的抗肿瘤免疫反应。然而,Hsc70水平在不同细胞类型中相对稳定,这为治疗性干预带来了不小的挑战。面对这一难题,研究团队通过药物筛选,发现Hsp90的抑制剂如AUY-922能够显著增强Hsc70水平,进而促进PD-L1的内体-溶酶体降解。不仅如此,AUY-922还进一步增强了aPD-L1和aCTLA4抗体药物的抗肿瘤效果,为癌症免疫治疗提供了新的策略。
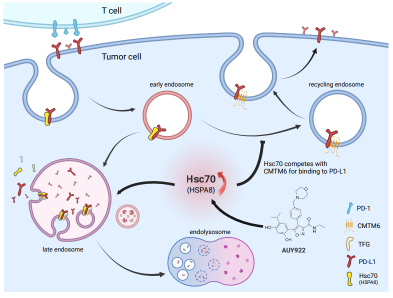
研究团队的成果不仅揭示了Hsc70调控抗肿瘤免疫的新机制,也为改善ICI耐药问题提供了新的思路和策略,有望在癌症免疫治疗领域发挥作用,为更多患者带来福音。
良渚实验室特聘副研究员徐晓燕,浙江大学医学院博士生谢庭雪,周梦欣,孙娅琴,汪枫祺为该论文的共同第一作者。浙江大学基础医学院/良渚实验室夏宏光教授为主要通讯作者,浙江大学医学院/良渚实验室王东睿研究员为共同通讯作者。
全文网址:https://doi.org/10.1038/s41467-024-48597-3










