细胞外囊泡(Extracellular vesicles, EVs)由于携带母体细胞来源的蛋白、核酸、脂质及代谢物等物质,可通过介导不同细胞间的信息交流,参与许多病理、生理过程,包括肿瘤进展、免疫反应、神经系统疾病和心血管疾病等。因此,通过调控EVs的生成可有效调控EVs相关疾病的进展。虽然,已有大量的研究揭示了EVs生成的相关机制,但EVs生成调控的可能性仍处于实验研究阶段,尚未见相关的临床药物可用于靶向EVs生成,从而治疗EVs相关的疾病。EVs被效应细胞摄取,从而向效应细胞内传递相关“货物”,是其发挥功能的先决条件。因此,除了调节 EVs的生成外,还可以通过调节细胞对EVs的摄取影响EVs的功能。通过促进非效应细胞对EVs的摄取,加速细胞外环境中EVs的清除,从而抑制效应细胞对EVs的摄取,有望抑制或终止EVs的功能。
2024年3月27日,浙江大学基础医学院蔡志坚教授/王建莉教授团队在国际胞外囊泡学会官方期刊Journal of Extracellular Vesicles杂志发表题为“Proton pump inhibitors enhance macropinocytosis-mediated extracellular vesicle endocytosis by inducing membrane v-ATPase assembly”的研究论文,揭示了质子泵抑制剂(Proton pump inhibitors,PPIs)通过调节细胞巨吞饮功能,控制细胞外环境中EVs的含量,从而影响EVs的功能及相关疾病的进展。

在筛选抑制细胞分泌EVs的药物时,团队研究人员发现PPIs可以明显减少细胞培养上清中EVs的含量。通过监测细胞对EVs的实时摄取(图1左)及EVs介导的Cre转移产生的细胞荧光转变(图1右),研究人员发现PPIs并不影响EVs的生成,却显著促进了细胞对EVs的摄取,从而导致EVs绝对产量的减少。
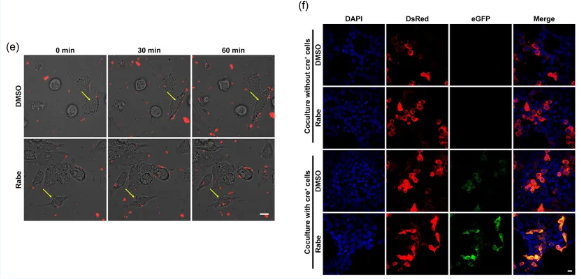
图1 PPIs促进细胞摄取EVs
通过深入的机制研究,研究人员发现,PPIs通过降低胞浆pH值,引起v-ATP酶ATP6V1A亚基从内体膜解离,并定位到质膜,促进质膜v-ATP酶的组装(图2),从而增强细胞的巨吞饮能力,加速细胞对EVs的摄取。
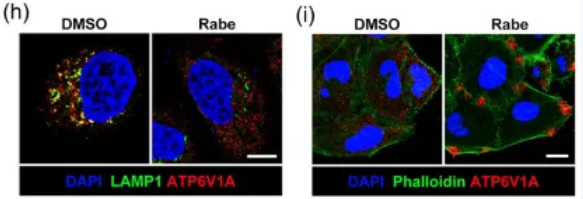
图2 PPIs促进内体ATP6V1A解离及质膜ATP6V1A招募
在此基础上,研究人员试图利用PPIs减少病理性EVs的含量,从而对EVs介导的相关疾病起到治疗作用。肿瘤细胞来源的EVs(Tumor cell-derived EVs, TEVs)可通过介导系统性免疫抑制促进肿瘤的进展。利用小动物活体荧光显微镜和活体成像(图3),研究人员发现PPIs可诱导肿瘤细胞对TEVs的再摄取,从而减少外周循环中的TEVs水平,激活抗肿瘤免疫,抑制肿瘤的进展。
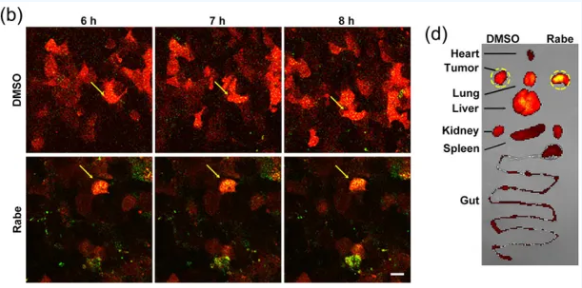
图3 PPIs促进TEVs被肿瘤细胞再摄取
此外,PPIs可提高抗PD-1治疗的敏感性。抗PD-1治疗无效的乳腺癌和黑色素瘤肿瘤小鼠,在联合应用PPIs时,对抗PD-1治疗出现响应。相应的,对临床病人资料的回顾性分析发现,与单独抗PD-1治疗相比,PPIs的联合治疗可明显提高肿瘤病人的无进展生存期。
除参与各种病理、生理进程,EVs还是天然的药物递送载体。由于其天然的细胞来源,与传统的病毒载体相比EVs具有许多独特的优势。比如,EVs具有更的生物兼容性和更低的免疫原性、可穿越血脑屏障、在很大程度上可避免药物的体内降解等。通过促进效应细胞对荷载药物EVs的摄取,有望增强 EVs的递送效率,从而提高载药EVs对相关疾病的治疗效果。因此,PPIs很可能通过提高靶细胞对载药EVs的摄取,提高EVs的递送效率。在随后的研究中,研究人员对这一设想进行了验证。发现PPIs可增强荷载阿霉素和miRNA-155反义寡核苷酸EVs的递送效率,进而提高载药EVs对肿瘤和急性肝损伤的疗效。
综上所述,研究人员发现了PPIs作为一种潜在的调控EVs含量的药物,通过调控细胞对EVs的再摄取,影响EVs介导的功能。
浙江大学基础医学院卢信良博士、浙江省肿瘤医院宋正波主任医师、浙江大学基础医学院郝嘉悦博士和孔祥辉博士为本文的共同第一作者。浙江大学基础医学院蔡志坚教授和王建莉教授为本文的共同通讯作者。










