单细胞染色质可及性分析(single cell ATAC-seq,scATAC-seq)和单细胞转录组(single cell RNA-seq,scRNA-seq)测序是单细胞多组学中应用最广泛的两个组学技术。主流的微流控体系和微孔板体系为高通量的单细胞或单细胞核分离提供了有效的方案。但微流控平台的封闭特性使得单细胞分隔之后很难再对其进行多步加样或其他操作,一些复杂步骤的组学技术体系较难在微流控体系内展开。开放式的pool-split方法能够灵活兼容不同单细胞组学技术,但在多轮混合-分散步骤中仍会有相当比例的细胞损失,与微流控体系类似,这些技术路线对细胞的起始量需求也比较高,难以处理珍贵样本与细胞/细胞核得率低的物种或组织。而微孔板体系的半开放,低成本,高捕获效率,兼容自动化操作等特性,能够解决从实验室应用到转化应用面临的一系列问题。
2024年3月26日,浙江大学基础医学院/良渚实验室郭国骥教授团队在Cell Discovery在线发表了题为“Fast and flexible profiling of chromatin accessibility and total RNA expression in single nuclei using Microwell-seq3”的研究论文,发布了新一代低成本、高通量、高兼容性的微孔板平台(Microwell-seq3)来检测单细胞中的总RNA表达与染色质开放性,系统比较了该技术在全长转录组范围及染色质可及性灵敏度提升的情况下,对小鼠多种组织细胞类型的兼容性,并展示了其快速鉴定衰老自发肿瘤中恶性细胞的应用场景。

郭国骥教授团队自2018年以来先后报道了具有自主知识产权的微孔高通量单细胞测序平台Microwell-seq及Microwell-seq2.0。在此基础上,Microwell-seq3结合了组合标记策略和兼容自动化加样的双通结构微孔芯片,在小试管中即可快速完成大量单细胞核的文库构建操作。单细胞核的处理使该技术能够兼容新鲜及冻存组织,在转录组文库构建的流程中,Microwell-seq3采用随机引物捕获细胞内包括mRNA,lncRNA在内的各种编码,非编码与小RNA。细胞核在进行原位逆转录反应或Tn5转座酶之后,接着将处理后的细胞核和微珠充分混合并转移至试管内的微孔芯片中(图1)。Microwell-seq3使用的双通可穿透孔微孔芯片并不完全依赖重力和泊松分布,而是通过毛细作用均匀的捕获流经表面含有细胞核与微珠的液体,避免了细胞的浪费。置于PCR管中的微孔芯片,每一轮反应都可在需要的温度下孵育,而芯片表面的油封可有效防止扩增步骤中可能出现的交叉污染。通过后续数据分析可区分并解码含有多个微珠或多个细胞核的微孔。
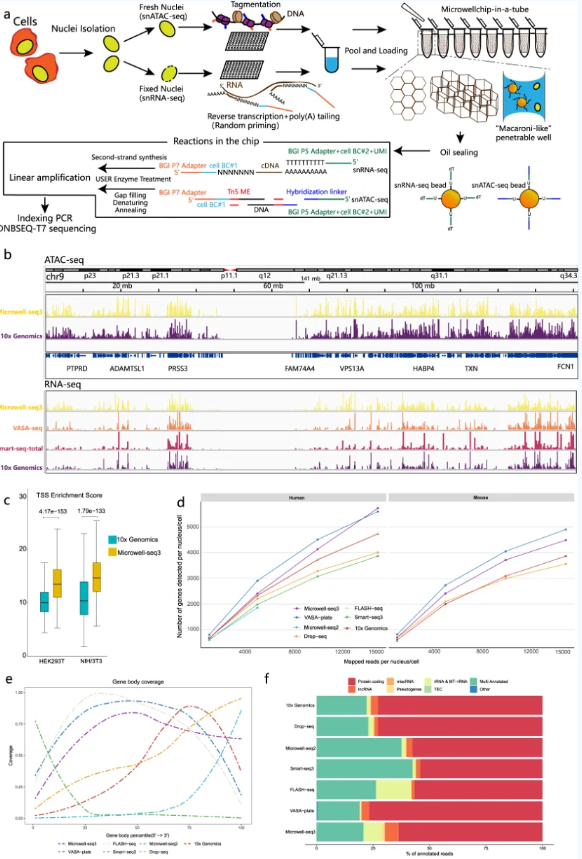
图1 Microwell-seq3实验原理流程及数据质控
Microwell-seq3人鼠混合细胞实验的数据表明,转录起始点(TSS)和转录终止点周围的读取信号和其他方法具有相似的区域富集特征。snRNA-seq的结果显示,Microwell-seq3的基因检测能力有所提高,且表现出很好的转录本全长覆盖。此外,Microwell-seq3检测数据中除编码RNA外,还含有9.3%的lncRNA。研究者进一步收集了多种成年小鼠组织,通过Microwell-seq3生成了单细胞总RNA与染色质可及性图谱。涵盖了各组织中的主要细胞类型,并联合RNA-seq与ATAC-seq基因调控网络,富集了大脑中主要细胞类型中的调控因子,提示结合多组学数据的调控网络比单一转录组层面能够提供更多信息。成年小鼠细胞总RNA与染色质开放图谱的绘制也展示了Microwell-seq3的优秀性能以及对各组织类型细胞的兼容性。
为探索Microwell-seq3在辅助临床诊断上的应用,研究尝试通过Microwell-seq3鉴定老年小鼠自发性肺部肿瘤中的恶性细胞。染色质可及性分析整合了肺肿瘤、肿瘤邻近组织及正常肺组织的数据,揭示包括常规肺泡I型细胞、II型细胞、Clara细胞、间皮细胞、成纤维细胞、内皮细胞和周细胞以及免疫细胞亚型。同时也鉴定到一群特征介于肺泡上皮细胞和间质细胞之间的肿瘤恶性上皮细胞,而通过拷贝数变异(CNV)预测提示该群恶性细胞存大量拷贝数变异模式,具有较高的肿瘤突变负荷。肿瘤特异性细胞亚群中的ATAC-seq信号显示在特定染色体区域拷贝数扩增或缺失的恶性细胞在肿瘤和肿瘤邻近组织中富集。通过SCRIP分析富集恶性细胞中激活的转录因子(TFs)及其调控的靶基因网络表明,肿瘤和肿瘤邻近组织的细胞表现出Foxc2(调控上皮-间质转化过程)、Nkx3-1(调节转移过程中移行恶性上皮细胞的细胞干性)、Foxm1、Nkx2-1、Tp63和Zeb1的高调控活性,而Trp53在正常组织中的调控活性相对较高。以上结果表明自发性肺肿瘤中的恶性上皮细胞表现出一定干性特征,以及介于间充质细胞和肺泡上皮细胞之间明确的上皮间质转化过渡状态,Trp63,Nkx2-1和Ki67等靶点的富集也提示该肺部肿瘤结节明确符合肺腺鳞癌的分子特征,部分调控基因也在免疫组化中得到了验证,证实该方法在能辅助肿瘤病理诊断的情况下,在单细胞基因调控层面提供更多的恶性细胞潜在靶点信息及其互作模式(图2)。
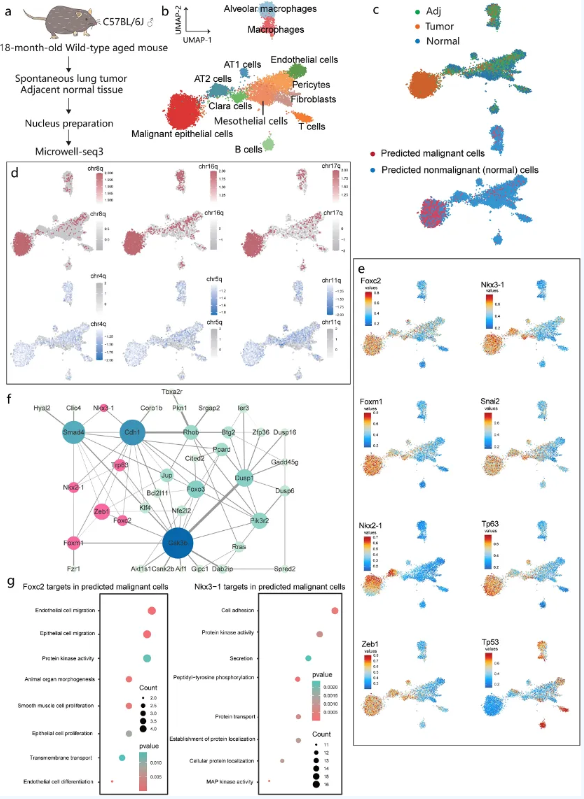
图2 老年小鼠自发性肺肿瘤分析
总的来说,本研究开发了新一代微孔板单细胞组学技术——Microwell-seq3,证实了其在全长转录组和染色质开放性层面对各类组织细胞的兼容性,验证了其在肿瘤恶性细胞鉴定中的应用,在单细胞水平为基因检测和调控靶点富集提供辅助信息。同时该技术平台的自动化兼容性也使得技术转化成为可能。
浙江大学基础医学院博士后叶昉,博士生张爽、博士生傅雨婷、博士生杨蕾、博士生张国栋和浙江大学附属第一医院邬一军主任医师为本文共同第一作者。浙江大学基础医学院/良渚实验室郭国骥教授为本文的通讯作者。本研究获得了国家重点研发计划、国家自然科学基金、国家基金委创新群体项目的支持。










