心血管疾病是全球的头号死因。心力衰竭是所有心血管疾病的终点,是人类与心血管疾病“最后的战役”,也是心血管领域尚未被攻克的“高地”。高血压和血栓等病理性刺激导致的心肌肥大是心力衰竭的主要诱因之一,抑制和逆转病理性心肌肥大以及延缓心肌重构的发展是心衰的主要治疗策略。尽管多种上市药物联合治疗很大程度改善了心血管疾病的治疗现状,但目前心衰领域仍然存在可用药物较少、药物机制和用药方法不明确导致的疗效不足、用药安全性问题等。因此,新靶点的发现和创新药物研发势在必行。
Apelin受体(APLNR)是A类G蛋白偶联受体(GPCR)家族成员,调节多种生理病理过程,包括体液稳态、焦虑和抑郁、心血管以及代谢性疾病。Apelin是APLNR的内源性配体,可同时激活APLNR下游的G蛋白和β-arrestin信号通路,在心血管系统功能调节中发挥着关键作用(图1)。
图1 APLNR介导的下游信号及病理生理功能
已有研究表明,APLNR激活可促进血管舒张、正性肌力、血管生成、利尿、降低血压等,还参与心血管疾病的病理生理调节,如抑制心肌纤维化、减轻病理性心肌肥厚、抵抗心力衰竭和肺动脉高压等,被认为是极有前景的心血管疾病干预靶点。APLNR的内源性配体apelin作为平衡激动剂,能够同时激活下游的多种信号通路;而某些配体可以诱导受体选择性结合某一种下游蛋白,使胞内信号偏向众多下游通路中的某一种通路传导,例如选择性激活G蛋白信号通路或β-arrestin信号通路,这类具有功能选择性的配体称为“偏向性配体”。内源性配体apelin诱导的心脏保护效应主要归因于APLNR的G蛋白信号,而β-arrestin信号的激活在健康人心脏中反而引起有害的心肌肥厚。因此,研究人员对开发G蛋白偏向的APLNR激动剂作为治疗心力衰竭的潜在药物越来越感兴趣。多家国际知名药企和科研机构如安进、阿斯利康、礼来、剑桥大学等都在尝试开发有效的APLNR激动剂类药物,目前已开发了若干β-arrestin信号减弱的部分G蛋白偏向激动剂,如MM07多肽和CMF-019小分子等,部分进入临床研究,但至今仍未有靶向该受体的分子成功获批上市。
本论文研究拨开了迷雾:动物实验显示部分G蛋白偏向激动剂所保留的较低β-arrestin信号仍会造成心肌肥大不良反应并且显著降低分子的药理效应。因此,开发只激活Gi信号,而完全不激活β-arrestin信号的绝对G蛋白偏向性APLNR激动剂,成为靶向APLNR受体药物发现的关键和难点,也为改善心肌肥大和心衰药物研发提供了新策略,有望为心血管疾病的治疗带来新突破。
北京时间2024年3月1日,浙江大学医学院、良渚实验室张岩教授课题组联合北京大学基础医学院张岩教授课题组合作在Cell上发表了题为Structure-based design of non-hypertrophic apelin receptor modulator的研究论文。该项研究通过解析APLNR与平衡激动剂和部分G蛋白偏向性激动剂的识别特征,揭示了APLNR偏向性信号转导的分子机制和结构基础,进而理性设计了具有绝对G蛋白信号选择性的APLNR激动剂WN353与WN561。其中,研究团队检测发现:相比于已有活性分子,WN561对心肌肥厚表现出良好治疗效果,并且能够显著降低潜在不良反应,为靶向APLNR的改善心血管疾病的药物开发提供了全新策略和物质基础。
浙江大学张岩教授团队长期致力于受体跨膜信号转导的机制研究和精准调控手段设计,奠定并发展了基于冷冻电镜的GPCR药理学研究方法,探索影响疾病发生发展和参与疾病调控的重要蛋白质机器的内在机制,为发现创新药靶和调控新机制提供理论依据,在基于结构设计精细调控GPCR功能的先导分子并实现疾病的精准干预方面取得了系列创新成果。北京大学张岩教授团队一直以来聚焦于心肌损伤的机制及其在心血管疾病中的作用,针对性的研发疾病防治靶点和干预手段,为临床心血管疾病的预防与治疗提供新策略。两位张岩教授团队优势互补,团结协作。
研究团队解析了内源性平衡激动剂apelin和两种部分G蛋白偏向性激动剂MM07和CMF-019激活APLNR进而偶联下游Gi1蛋白复合物的高分辨率冷冻电镜结构。结果显示:尽管三种激动剂结合的APLNR-Gi1复合物具有相似的整体结构,但这些激动剂的识别模式存在细微却关键的差异,结合配体口袋关键残基丙氨酸突变的下游信号功能实验检测,研究者发现受体中与多肽配体M11和F13残基相互作用的特定氨基酸作为“双热点”协同调节受体对下游信号转导的选择性。因此他们设想通过改造11位和13位氨基酸能够改变配体与“双热点”的相互作用实现对下游信号选择的精准调控(图2)。
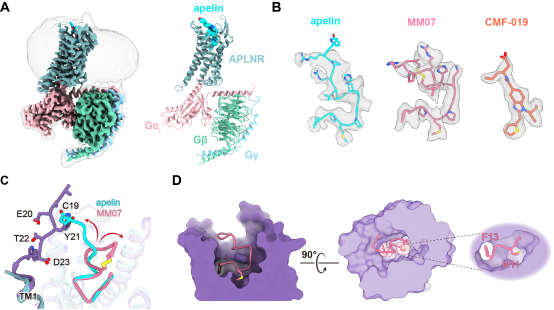
图2 三种激动剂结合的APLNR-Gi1复合物冷冻电镜结构解析并定义“双热点”
此外,他们还揭示了由配体结合口袋传递到下游效应蛋白结合口袋的信号转导机制,其中位于受体胞质侧的极性网络中心的D752.50残基发挥偏向性信号开关的功能,其1.2埃的结构偏移促进了受体胞质侧氢键网络的重排,可能导致下游效应蛋白结合口袋采取不同构象,从而实现对下游效应蛋白的选择性偶联。同时,研究表明D752.50与N461.50的氢键作用也是β-arrestin结合的关键;值得一提的是这两个残基在近400种A类GPCR超家族的第一和第二个跨膜螺旋中绝对保守。进而他们提出假设:破坏D752.50与N461.50的氢键作用可能是获得完全G蛋白偏向性激动剂的关键(图3)。
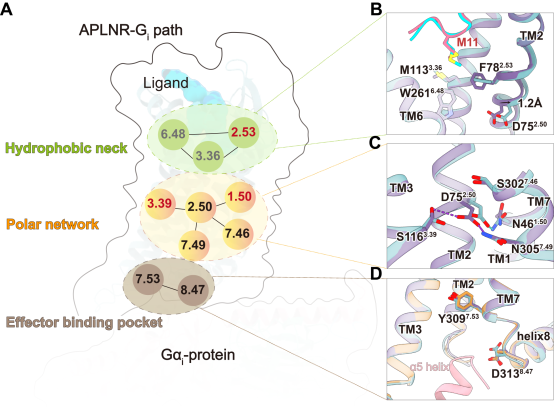
图3 信号通过极性网络向胞内传递
基于以上不同偏向性信号分子识别并激活APLNR的分子机制和结构基础,浙江大学张岩教授团队成功设计出了完全G蛋白偏向性激动剂WN353和WN561,在消除β-arrestin活性的同时保持了G蛋白信号转导能力。进一步解析的WN353和WN561激活APLNR-Gi1复合物的三维模型显示D752.50与N461.50氢键作用缺失,验证了上述假设,进一步阐述了APLNR偏向性信号转导的机制。
随后,研究团队利用体外培养心肌细胞和在体心脏疾病动物模型,对新研发的APLNR绝对G蛋白偏向性激动剂以及现有的平衡激动剂和部分G蛋白偏向性激动剂进行了功能筛选和验证。结果显示在生理(normal)条件下,给与Aapelin能够诱导心肌肥大,表明其存在安全隐患。这些发现与前人研究一致,验证了APLNR的β-arrestin信号通路是导致心肌肥大的主要通路。然而,在临床中经常存在病理刺激消除但仍保留了心肌肥大的情况。例如,患有瓣膜疾病或高血压的患者通过手术或药物消除病理刺激,仍然会发展心肌肥大。研究者检测了这一情况下几种APLNR激动剂的治疗效果,发现Aapelin在具有肥大心脏但无病理刺激(ISO)的小鼠中加剧了心肌肥大,而部分G蛋白偏向性激动剂(MM07和CMF-019)没有改善效果。令人兴奋的是,研究团队新开发激动剂WN561在有或没有病理刺激的条件下均可显著改善小鼠心肌肥大,进一步证明了这种新型完全G蛋白偏向性APLNR激动剂在治疗心肌肥大和心力衰竭中的治疗前景。本研究中提出的偏向性信号转导机制和apelin类似物设计策略有助于开发靶向APLNR的新一代心血管疾病治疗药物(图4)。
图4 新型完全APLNR偏向激动剂WN561的设计理念及心肌保护活性效果
该项研究工作揭示了APLNR与不同偏向性配体复合物的识别特征,首次成功理性设计了绝对G蛋白信号选择性的APLNR激动剂。通过三种动物模型展示了新设计活性分子的安全性和有效性,为靶向APLNR的改善心血管疾病药物开发提供了全新策略。
浙江大学医学院、良渚实验室张岩教授和北京大学基础医学院张岩教授为该论文共同通讯作者。浙江大学博士后王伟伟、博士生戢素玉、北京大学基础医学院博士生张文佳、北京大学第三医院博士后张俊霞、浙江大学博士生蔡晨曦、强基计划本科生胡如碧为本文共同第一作者。此外,浙江大学博士生臧绍琨、陈礼楠、杨宗块、郭嘉、秦娇、沈丹丹,良渚实验室博士后徐豪芒,技术员苗路伟等也做出了贡献。浙江大学转化医学研究院梁平教授对本论文提供了帮助。本研究得到国家自然科学基金重大项目、国家科技部科技重点研发项目和浙江省尖兵领雁项目等资助。冷冻电镜数据收集和处理得到良渚实验室冷冻电镜中心支持。
浙江大学张岩教授团队长期致力于受体跨膜信号转导的机制研究和精准调控手段设计,奠定并发展了基于冷冻电镜的GPCR药理学研究方法,探索影响疾病发生发展和参与疾病调控的重要蛋白质机器的内在机制,为发现创新药靶和调控新机制提供理论依据,在基于结构设计精细调控GPCR功能的先导分子并实现疾病的精准干预方面取得了系列创新成果。北京大学张岩教授团队一直以来聚焦于心肌损伤的机制及其在心血管疾病中的作用,针对性的研发疾病防治靶点和干预手段,为临床心血管疾病的预防与治疗提供新策略。










