真核生物线粒体的氧化磷酸化系统包括呼吸链复合物I-IV与ATP合成酶(复合物V),是好氧生命获取能量的主要方式。其中跨膜蛋白复合物I-IV将来自糖酵解和三羧酸循环的还原力(NADH、琥珀酸等)的电子传递给氧气分子,并通过建立跨线粒体内膜质子梯度驱动ATP合成酶合成ATP。长期以来,以上系统的结构与工作机制是生物能量学领域的研究重点,特别是由复合物I-IV按特定比例组成的超级与超超级复合物(Supercomplex and Megacomplex)。最经典的例子是在哺乳类呼吸链中发现的超级复合物SC I+III2+IV,因其包括了催化从NADH到O2电子传递的全部分子机器而被称之为“呼吸组(respirasome)”。
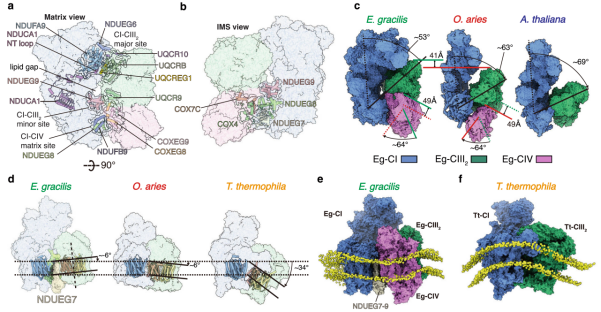
随着冷冻电镜技术的发展,SC I+III2+IV呼吸组结构已在真核生物界的多个演化支中被解析,这包括后鞭毛演化支(真菌+动物)和泛植物演化支(藻类+维管植物)等。浙江大学医学院周龙课题组前期解析了囊泡虫演化支经典模式生物嗜热四膜虫(Tetrahymena thermophila)线粒体呼吸链的超级复合物(2022 Science)与超超级复合物(2023 Nature Comms)的结构,揭示了许多特有的工作机制和呼吸链高阶聚集形态对管状嵴的适应性。然而以上工作并未覆盖真核生物全部演化支,故而仍然不能完全明确呼吸链的进化过程,以及线粒体-核基因组协同进化对呼吸链复合物的影响。
2024年2月22日,浙江大学医学院周龙课题组、浙江大学生命科学学院王勇课题组和浙江大学医学院附属邵逸夫医院周建仓课题组合作在Nature Communications期刊发表了题为“Euglena’s Atypical Respiratory Chain Adapts to the Discoidal Cristae and Flexible Metabolism”的研究论文,解析了古虫演化支模式种纤细眼虫(Euglena gracilis)呼吸链超级复合物SC I+III2+IV、SC III2+IV2及单独复合物I在热失活、NADH还原、底物回转等多个状态下的冷冻电镜结构,并据此分析了他们与已知类群相比独有的工作机制。

古虫演化支(Excavata)目前被拆分为盘嵴、后滴、半鞭毛虫等多个超类群(Supergroups),虽然有相当数量针对其线粒体呼吸链的研究,但目前仍欠缺高分辨率结构报道。在线粒体进化层面上,古虫界盘嵴亚界具有类似成熟红细胞形状的特征性盘状嵴,其代表种纤细眼虫的线粒体基因组高度简化,仅编码7个蛋白质,与哺乳类相比缺失编码复合物I核心跨膜亚基ND2的基因;而与之相比四膜虫线粒体基因组可编码33个蛋白质,其中包括了呼吸链的非核心附属亚基。在代谢方式层面上,纤细眼虫可以进行有氧呼吸和无氧蜡质发酵,并可通过次生获取的色素体进行光合作用。总的来讲,纤细眼虫在线粒体进化上的重要地位和综合性的代谢策略与其呼吸链有限的研究极不相称,限制了对真核生物能量代谢系统自内共生事件以来进化过程的理解。
与哺乳类经典的呼吸组SC I+III2+IV结构(1.7 MDa)相比,纤细眼虫SC I+III2+IV分子量达到2.6 MDa,在其复合物I(1.6 MDa)与IV(460 kDa)中分别鉴定出了12与9个未曾在呼吸链中报道过的物种特异性亚基。本文发现纤细眼虫复合物I不完全符合哺乳类7+7核心亚基的布局,其基质臂的NDUFS1和膜内臂的ND2两个核心亚基均分裂成A、B两部分。虽然前期报道的四膜虫复合物I也出现类似的跨膜核心亚基ND1、ND2和ND5的分裂,但膜外核心亚基的分裂属首次报道;而纤细眼虫分裂的跨膜核心亚基ND2不再由线粒体基因组编码,推测分裂过程与降低该亚基疏水性从而有利于核基因翻译后向线粒体转运有关。
值得注意的是,在纤细眼虫复合物I的基质臂顶端发现了由数个与脂肪酸合成代谢相关酶类在结构上同源的亚基组成的“脂肪酸合成结构域”,具体包含负责在b-氧化逆过程中将2-反式烯酰CoA/ACP还原为饱和碳氢链的烯酰CoA/ACP还原酶同源亚基NDUEG3和NDUEG5,酰基CoA合成酶同源亚基NDUEG1以及磷酸烯醇式丙酮酸羧激酶(PEPCK)同源亚基NDUEG2。这一结构域在前期对纤细眼虫复合物I的质谱研究中已被发现,而它与呼吸链复合物的结合在其他物种中均没有报道。然而,序列比对和酶活检测均提示该脂肪酸合成结构域已经失去了活性。这与哺乳类复合物I中存在的短链脱氢酶(SDR)同源亚基NDUFA9,核苷激酶同源亚基NDUFA10,以及在非后鞭毛物种复合物I中广泛存在的g-碳酸酐酶三聚体类似,均在增加呼吸链复合物结构复杂性的同时,并不增加呼吸链的功能范围。线粒体进化过程中出现这种情况的原因是本领域一个争论焦点,作者在文中从好氧-厌氧代谢通路整合的主动自然选择,以及线粒体-核基因组协同进化过程中的遗传漂变两个方向进行了可能的分析。
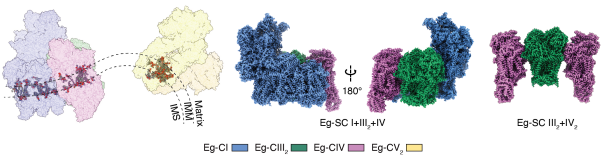
另一方面,纤细眼虫超级复合物SC I+III2+IV的基本架构与哺乳类呼吸组相比也存在不同。其中复合物III2的位置发生显著移动,与复合物I的结合位点从远端的核心亚基ND5附近向前移动到基质臂侧面的附属亚基NDUFA9处;而复合物I-III2在远端的传统结合界面则改为由复合物IV介导。这就解释了为何纤细眼虫呼吸链仅存在超级复合物SC I+III2+IV,而不存在较小的超级复合物SC I+III2,因为复合物IV的脱落会导致复合物I-III2结合界面丧失而分离。值得注意的是,超级复合物SC I+III2而非呼吸组SC I+III2+IV是真核生物各演化支中最保守的超级复合物组合形式,纤细眼虫的特殊构架似乎提供了唯一反例。从磷脂双分子层的平面来看,与哺乳类呼吸组跨膜部分的平面分布,四膜虫的~34°的正曲率分布不同,纤细眼虫呼吸组跨膜部分呈现~-6°的负曲率,这与其盘状嵴边缘与中心位置交界处的负膜曲率相吻合。分子动力学模拟实验证明纤细眼虫呼吸组可在其附近自主诱导负膜曲率,再次为呼吸链高阶聚集形态对线粒体嵴形态发生的影响提供了证据。
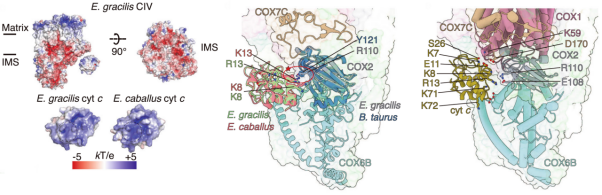
除以上发现外,作者还探究了纤细眼虫复合物I“激活-失活”转变的机制。与哺乳类复合物I不同,四膜虫、高等植物和纤细眼虫复合物I均存在连接基质臂与膜内臂的“铁氧还蛋白桥”,限制了复合物I“开放-闭合”构象的变化和相应活性的转变。本文中作者通过解析纤细眼虫复合物I在不同活性状态下的结构,提出了此类复合物I基于辅酶Q通道开闭的活性转变新机制。此外,与四膜虫类似,纤细眼虫复合物IV仅能识别自身的细胞色素c,但这种机制并不是由类似四膜虫的界面电荷反转造成的。通过分子动力学模拟实验,作者提出纤细眼虫复合物IV特有的“头盔状”结构域对非自身细胞色素c起到了筛选屏蔽的作用,从而以不依赖电荷的方式实现特异性底物识别。
总的来说,本研究在前作基础上进一步揭示了线粒体呼吸链惊人的进化多样性。浙江大学医学院博士研究生何召祥、吴梦晨和田红涛为本文共同第一作者;浙江大学周龙研究员、周建仓教授和生命科学学院王勇研究员为本文通讯作者。本研究受到了国家自然科学基金委和浙江省自然科学基金委等的资助,并得到了浙江大学冷冻电镜中心、医学院公共技术平台、浙江大学计算机辅助设计与图形学(CAD&CG)国家重点实验室的大力支持,在此一并致谢。
原文链接:https://www.nature.com/articles/s41467-024-46018-z#Bib1










