作为肠腔内最丰富的代谢产物之一,丁酸已被证实参与多种生理病理过程,如生酮饮食代谢产生的丁酸盐可在人体发挥抗结肠癌的作用;膳食纤维的摄入可增加肠道丁酸产生,通过肠脑轴调控阿尔茨海默症;口服3-羟基丁酸,可有效发挥抗炎、抗粥样硬化等效果。此外,丁酸盐和3-羟基丁酸可以穿过血脑屏障,对一系列精神类疾病也有潜在应用价值。基于此,探究丁酸物质及其感应受体具有重要生理学和药理学意义。
羟基羧酸受体HCAR2,又被称为GPR109A,是羟基羧酸受体家族三驾马车之一,可识别3-羟基丁酸(3-HB),丁酸盐,烟酸(Niacin)等代谢物,调控下游信号通路发挥抗炎、抗癌等作用。然而,目前靶向HCAR2的配体存在激活能力弱或者强烈副作用等问题,如3-羟基丁酸和丁酸盐等,需要1-10mM的浓度才能激活HCAR2调控下游;烟酸激活能力稍高,但用于粥样硬化治疗时,易产生面部潮红副作用,降低患者依从性。研究显示,面部潮红副作用主要来自于HCAR2的arrestin通路,而抗炎等作用则主要由Gi通路介导。探究HCAR2识别不同配体的结构基础及信号转导机制可为后续精准药物,尤其是G蛋白偏向性药物等开发提供物质基础和理论指导。

2023年11月22日浙江大学基础医学院张岩课题组和毛春友课题组、江南大学马鑫课题组与北京大学医学部卢言慧课题组在Nature子刊Nature Communications上发表了题为“Orthosteric and allosteric modulation of human HCAR2 signaling complex”的研究论文。
本研究首先利用单颗粒冷冻电镜技术分别解析了HCAR2与内源性激动剂3-羟基丁酸(3-HC)、小分子激动剂烟酸(Niacin)和G蛋白偏向性激动剂MK-6892、正向别构调节剂compound 9n复合物的高分辨电镜结构。不同配体(Niacin和compound 9n、3-HB和compound 9n、MK-6892)结合下复合体的整体分辨率分别为 2.5 Å、2.6 Å 和 2.8 Å。结构分析表明,与经典Class A GPCR不同,HCAR2整体结构更为紧凑,细胞外侧被ECL和受体N末端包围。而且除ECL2与TM3胞外端间形成的保守二硫键外(C100-C177),HCAR2的N端还与ECL2和ECL3形成两对额外的二硫键(C18-C183、C19-C266),可能在稳定配体结合上发挥着关键的作用。
随后,结合细胞功能实验,研究者对平衡配体3-HB和Niacin的识别模式进行了阐述,不仅找到了二者识别的差异氨基酸,还进一步发现Niacin激活能力更强的原因可能来自于吡啶环与口袋更多的疏水相互作用,这与分子动力学模拟结果一致,也提示后续药物设计时应着重考虑与正构口袋的疏水作用。此外由于3-HB的结合不稳定,团队通过分子动力学模拟发现模拟轨迹中3-HB从正构口袋中解离。从解离路径中可以明显看出,当模拟进行至一定时间后(约500 ns),原本包被正构口袋的N端和ECL2打开,使得3-HB从TM4-ECL2-TM5的间隙中解离。解离路径的分析有助于理解整个配体的结合过程和配体弱活性的分子基础,为具有更强结合力和更高活性的分子设计和药物开发提供思路。
除了平衡配体,本研究还比较了G蛋白偏向性配体MK-6892与平衡配体结合的差异,发现MK-6892的结合会导致受体TM4-ECL2-TM5区域发生明显的构象变化,在内源配体口袋基础上延伸出一个额外的配体区域,这可能是其G蛋白选择性的来源。因此对MK-6892结合口袋的鉴定和分析,有助于以此为基础开发新一代G蛋白偏向性药物。
正向別构激动剂(PAM)可有效降低配体激活浓度,与正构配体药物联用时,有可能达到改善病症而不引发副作用的效果。在本研究中,研究团队也探究了HCAR2的正向別构激动剂compound 9n的识别机制,发现其结合位点与目前已知A类GPCR的PAM结合位点结合不同。compound 9n结合在胞外侧TM5-TM6-ECL2之间形成的口袋中,使正构口袋激动剂Niacin和3-HB的激活能力分别提高约19倍和12倍。为探究compound 9n的作用机制,团队还进一步进行了分子动力学模拟,通过统计整个模拟轨迹中配体的坐标位置,可视化了模拟轨迹中配体的整体分布频率,得到配体的概率分布图,发现当存在compoun 9n时,配体更集中分布在初始位置附近,意味着配体更稳定地与受体结合。因此,研究团队确认了compound 9n的正向协同作用可能主要源自其对正构口袋的稳定作用,这为靶向HCAR2药物研发提供了一个新型策略。
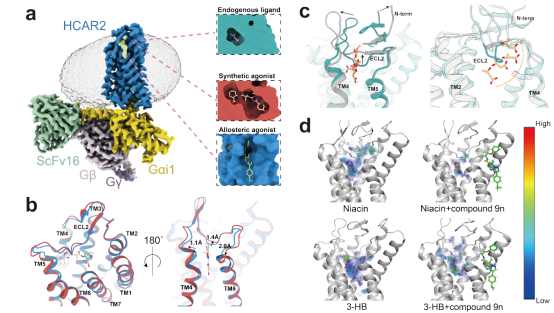
图. 羟基羧酸受体激活模式与变构调控机制。
a,HCAR2的三维结构样貌,以及内源性激动剂3-HB、G蛋白偏向性激动剂MK-6892和正向別构调节剂compound 9n的口袋特征。
b,Niacin(蓝色)和MK-6892(红色)结合下的HCAR2结构差异,MK-6892的结合使TM4-ECL2-TM5发生明显的结构变化。
c,3-HB的解离路径示意图,灰色为模拟起始构象,青色为3-HB解离时(约500 ns)构象。随着模拟的进行,原本包被在3-HB上方的ECL2和N末端发生了不同程度的外移,使得TM4-ECL2-TM5间产生充足的空隙,原本封闭的口袋打开,3-HB沿橙线所示路径解离。
d,配体分布概率示意图,模拟起始时的受体、配体(Niacin、3-HB)、compound 9n构象分别标为灰色、紫色、绿色,点由蓝到红代表配体分布概率由低到高。经对比,显然存在compound 9n时配体分布更集中在初始构象附近,这一变化在配体为Niacin时更为显著,由此证明compound 9n的正向协同机制可能为稳定正构口袋中配体的稳定。
综上所述,此研究阐明了羟基羧酸受体HCAR2的配体识别、别构激活机制。不仅通过对多种正构激动剂的研究极大地促进靶向HCAR2的药物发现,而且研究发现的新型别构调节口袋也为相关药物开发提供了一个新的方向。
浙江大学医学院附属邵逸夫医院毛春友研究员,江南大学博士后高梦茹,浙江大学基础医学院博士研究生臧绍琨、博士后祝岩清为论文共同第一作者;浙江大学基础医学院张岩教授,江南大学医学院马鑫教授,浙江大学医学院附属邵逸夫医院毛春友研究员和北京大学医学部卢言慧副研究员为共同通讯作者;良渚实验室冷冻电镜平台和浙江大学冷冻电镜中心为数据收集提供了大力支持;研究工作得到了科技部、国家自然科学基金、浙江省自然科学基金的资助。
论文链接: https://www.nature.com/articles/s41467-023-43537-z










