支架蛋白胰岛素受体底物1(IRS-1)是胰岛素/IGF信号传导中的一个重要节点。人们早就认识到,IRS-1的稳定性取决于其内膜靶向性。然而,IRS-1如何靶向细胞内膜,以及实际靶向的细胞内膜类型,仍知之甚少。
2023年8月1日,浙江大学周以侹、郑莉灵、蒋靓君及高修奎共同通讯在《Cell Discovery》在线发表了题为“VAPB-mediated ER-targeting stabilizes IRS-1 signalosomes to regulate insulin/IGF signaling”的研究论文,该研究揭示VAPB介导的ER靶向稳定IRS-1信号体以调节胰岛素/IGF信号传导。该研究发现相分离介导了附着在内质网(ER)上的IRS-1点。VAPB是一种ER锚定蛋白,介导ER和其他细胞器膜之间的连接,被鉴定为IRS-1的直接相互作用伴侣。VAPB主要结合活性IRS-1,因为IGF-1增强了VAPB-IRS-1的结合,并且YXXM基序的9个酪氨酸残基的取代破坏了VAPB-IRS-1的连接。
该研究进一步描述了IRS-1的FFAT样基序中的Y745和Y746残基介导了与VAPB的结合。值得注意的是,VAPB将IRS-1靶向ER,随后保持其稳定性。一致地,小鼠VAPB的消融导致IRS-1的下调、胰岛素信号传导的抑制和葡萄糖不耐受。肌萎缩侧索硬化症(ALS)衍生的VAPB P56S突变体也通过干扰IRS-1的内质网束缚而损害IRS-1稳定性。总之,该研究揭示了一种以前未被重视的凝聚物-膜接触(CMC),VAPB通过将其靶向ER膜来稳定无膜IRS-1信号体。
另外,2022年6月28日,浙江大学周以侹、郑莉灵及鲍彰共同通讯在《Cell Discovery》在线发表了题为“Phase separation of Insulin Receptor Substrate 1 drives the formation of insulin/IGF-1 signalosomes”的研究论文,该研究描述了IRS-1介导的信号体的LLPS作为胰岛素/IGF-1信号传导的组织中心的机制,并暗示了异常IRS-1 LLPS在代谢性疾病中的作用。


作为真核细胞中最丰富的膜室, ER与其他细胞器形成多重接触,为细胞器通讯、脂质转移和钙信号传导提供平台。越来越多的证据表明,ER也与通过生物分子缩合/相分离形成的无膜细胞器有关。最近的研究表明,ER膜表面直接影响系留冷凝物的组装和尺寸。VAP(VAPA和VAPB)是在ER和其他细胞器膜之间产生束缚的主要参与者。然而,VAP是否参与介导凝聚物-膜接触(CMC)在很大程度上仍未被探索。
胰岛素/胰岛素样生长因子(IGF)信号调节多种关键生理事件,包括分化、代谢和生长。支架蛋白IRS-1作为胰岛素/IGF途径中的关键节点,募集并激活下游含有Src同源性2(SH2)的效应子。IRS-1的细胞内膜附着与其磷酸化状态相关,并决定其周转。细胞内膜部分含有Tyr磷酸化的活性IRS-1,而IRS-1的胞质再分配导致降解。然而,IRS-1实际靶向的细胞内膜类型尚不清楚。鉴于IRS-1中没有跨膜结构域,IRS-1信号体如何靶向细胞内膜也仍然未知。
该研究发现相分离介导的IRS-1液滴靶向ER。研究者的筛选进一步确定ER锚定蛋白VAPB是IRS-1的潜在相互作用伙伴之一。事实上,该研究描述了介导IRS-1–VAPB相互作用的关键氨基酸残基,并表明VAPB介导的CMC通过将其靶向ER来稳定IRS-1。敲除VAPB导致小鼠IRS-1表达减少、胰岛素信号受损和葡萄糖稳态异常。肌萎缩侧索硬化症(ALS)衍生的VAPB P56S突变体损害IRS-1的稳定性和ER束缚。基于这些观察,ER及其VAPB介导的与无膜IRS-1信号体的连接可能与胰岛素/IGF信号的调节有关。
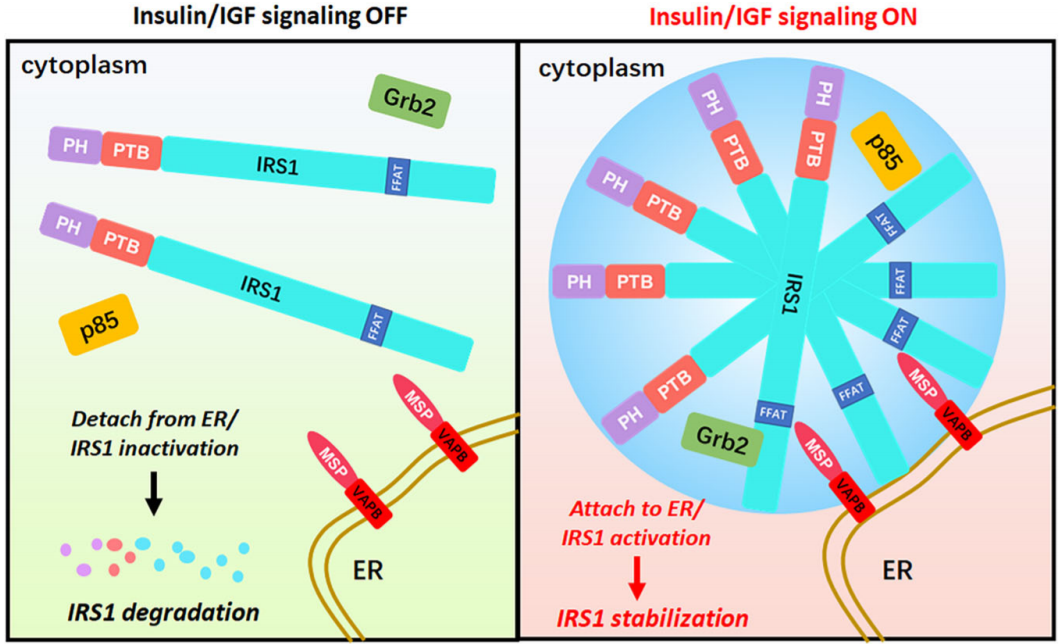
文章模式图(图源自Cell Discovery )
值得注意的是,VAPB将IRS-1靶向ER,随后保持其稳定性。一致地,小鼠VAPB的消融导致IRS-1的下调、胰岛素信号传导的抑制和葡萄糖不耐受。肌萎缩侧索硬化症(ALS)衍生的VAPB P56S突变体也通过干扰IRS-1的内质网束缚而损害IRS-1稳定性。总之,该研究揭示了一种以前未被重视的凝聚物-膜接触(CMC),VAPB通过将其靶向ER膜来稳定无膜IRS-1信号体。
原文链接:
https://www.nature.com/articles/s41421-023-00576-6
https://www.nature.com/articles/s41421-022-00426-x










