真核细胞的有氧呼吸依赖于位于线粒体嵴上的氧化磷酸化(Oxidative phosphorylation, OXPHOS)系统,包括由跨膜蛋白复合物I-IV(CI-CIV)组成的电子传递链(Electron transport chain, ETC)和由ATP合成酶/复合物V(CV)单独构成的ADP磷酸化机器,二者通过跨线粒体内膜的质子电化学梯度实现能量耦联。真核生物氧化磷酸化机器结构的进化历程与多样性是领域内近期涌现的一个研究热点。自冷冻电镜技术的分辨率革命以来,已有包括真菌与动物界在内的后鞭毛演化支,以及包括藻类和陆生植物在内的泛植物演化支的ETC复合物与超级复合物(Supercomplex)结构被解析。嗜热四膜虫(Tetrahymena thermophila)作为一种经典的原生动物模式种,代表着真核生物种有别于酵母和动植物的囊泡虫演化支。其高度特化的ETC超级复合物SC I+III2(2.3 MDa)与CIV2(2.7 MDa)结构在近期被报道,体现出了对其特有的管状嵴的适应性。四膜虫OXPHOS系统尚存在的更加巨大的超超级复合物(Megacomplex),其结构与工作机制的研究彼时尚属空白。
2023年5月29日,浙江大学基础医学院生物物理系周龙课题组在Nature Communications在线发表了题为“Structures of Tetrahymena thermophila respiratory megacomplexes on the tubular mitochondrial cristae”的研究论文,解析了嗜热四膜虫~5.8 MDa的超级复合物SC IV2+I+III2+II,~8 MDa的超超级复合物MC IV2+(I+III2+II)2的和~10.6 MDa 的超超级复合物MC (IV2+I+III2+II)2分别2.89 Å,2.96 Å以及4.18 Å的冷冻电镜结构,生动展示了其电子传递链高级装配形式对管状嵴的适应性,并在功能上提示了电子载体辅酶Q(CoQ)在其内部通过底物通道进行高效穿梭的可能性。本研究明确了复合物II是四膜虫呼吸链超级与超超级复合物的组成成分之一,展示了为适应膜曲率各复合物相较于经典的哺乳类呼吸体(Respirasome)发生显著重排,并且通过与前期发表的四膜虫SC I+III2结构比较说明在超复合物SC I+III2中功能对称性遭到破坏的CIII2二聚体,当加入CII形成超超级复合物后,其远离CI的单体功能得到了恢复。这提示在四膜虫的电子传递链高级装配形式中,CIII2两个单体分别负责氧化来自CI和CII的还原性CoQ,为电子传递链超级复合物的形成是否有利于CoQ通过底物通道穿梭这一长期争论的课题提供了有力的结构注脚。

本研究发现,嗜热四膜虫MC IV2+(I+III2+II)2的跨膜部分整体分布在~160°的弧面上,其直径与纤毛纲~40 nm的管状嵴直径相吻合。作者前期报道的四膜虫SC I+III2虽包含大量哺乳类中未出现的亚基,但CI与CIII2结合的相对位置相较后鞭毛与泛植物等演化支仍保持保守。在超超级复合物的层面上,与哺乳类呼吸体的经典结构模式不同,四膜虫高度增大的CIV2强制二聚体无法简单结合在CI跨膜结构域的远端,而采用通过与CI跨膜区未结合CIII2的一侧互作实现超超级复合物的形成。CI跨膜区远离CIII2的一侧在真核生物所有已知结构的超级/超超级复合物中均暴露在磷脂双分层中,而本研究提示在OXPHOS系统进化过程中此表面存在通过与其他复合物互作而链接多个呼吸链超级复合物的潜在可能。由于四膜虫CIV2为强制二聚体,其两侧表面可以分别结合一个SC I+III2形成C2对称的结构。这样一来,此前报道的SC I+III2与CIV2跨膜区各~50°的弧度可以连接成一个~160°的弧面,成为呼吸链高级聚集形式与嵴形态在进化中相互适应的生动范例。
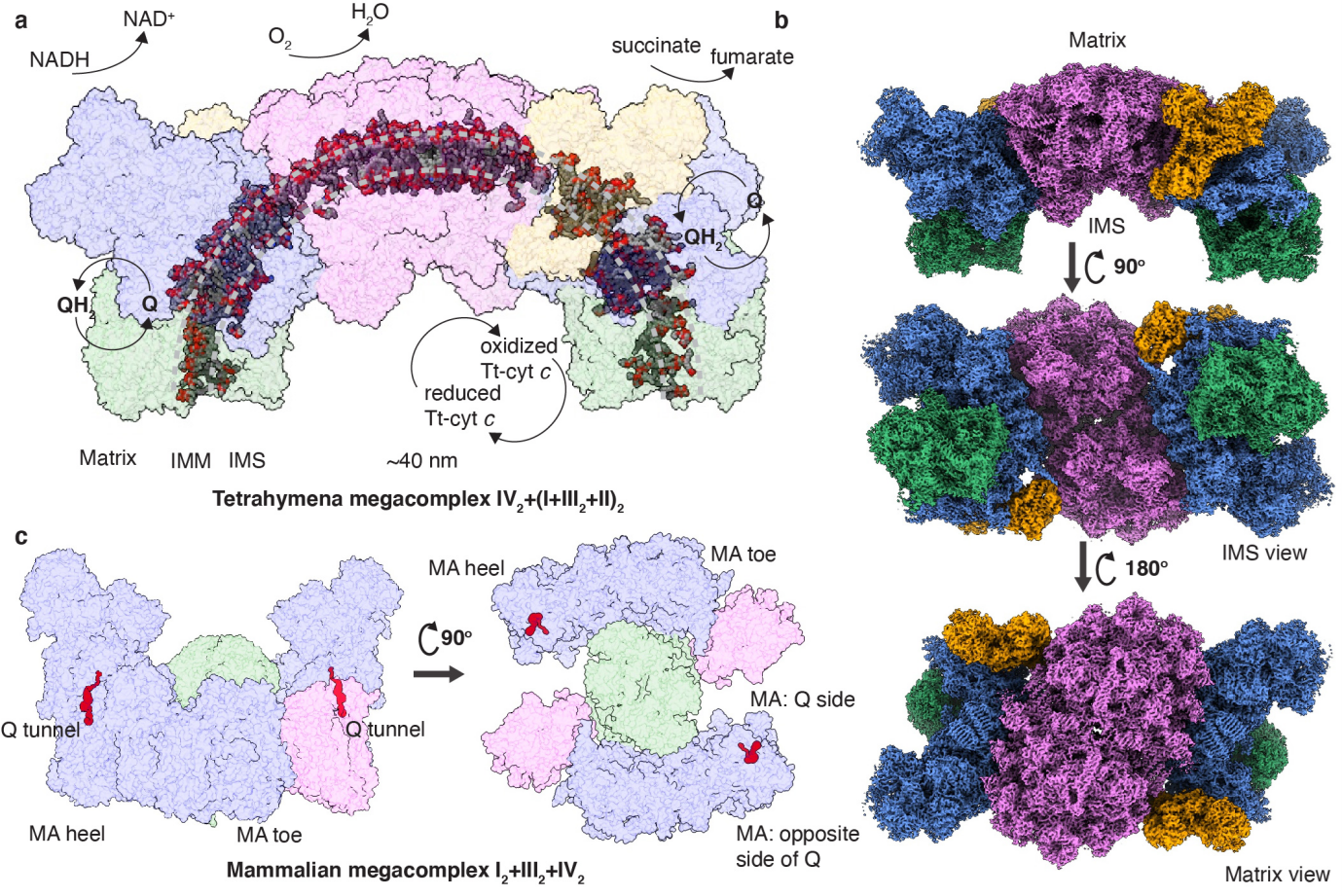
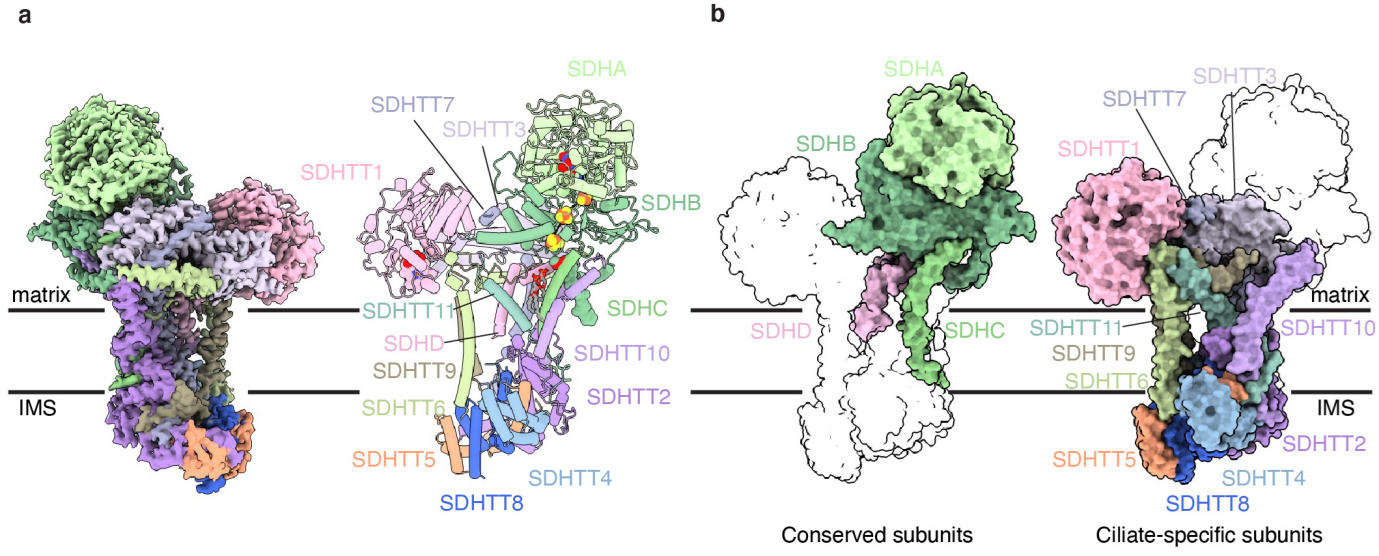
作为连接三羧酸循环与电子传递链的复合物II是否参与超超级复合物的形成长期以来存在争论,而已有的哺乳类超超级复合物结构并未显示复合物II的密度。本研究显示四膜虫CII是其超超级复合物的一部分,通过卡进CIV2与CI跨膜区远端形成的凹槽内与二者结合,每个MC IV2+(I+III2+II)2内存在两个CII。这再一次体现了巨大且强制二聚的CIV2在组织四膜虫超超级复合物中的核心作用。四膜虫CII结构上与原核与真核生物的A-F类琥珀酸脱氢酶(Succinate dehydrogenases, SDH)以及相关的延胡索酸还原酶(Quinol:fumarate reductases, QFR)结构均有很大差异。其类似字母Y的造型包括两个可溶性头部结构域,除SDHA与SDHB的核心亚基外尚有由四膜虫特异性亚基SDHTT1构成的另一个亲水结构域。其膜内核心亚基SDHC与SDHD相较于哺乳类6次跨膜的经典结构简化为4次跨膜,但额外存在SDHTT2-10等特有亚基加强了跨膜区结构,并形成了一个未报道过的膜间质侧亲水结构域。通过四膜虫由两个超级复合物SC IV2+I+III2+II侧面对接形成的~10.6 MDa MC (IV2+I+III2+II)2结构分析可知,此CII的膜间质侧结构域可通过自身二聚协助两个超超级复合物半圆的结合,从而实现电子传递链复合物在管状嵴上的紧密堆积。
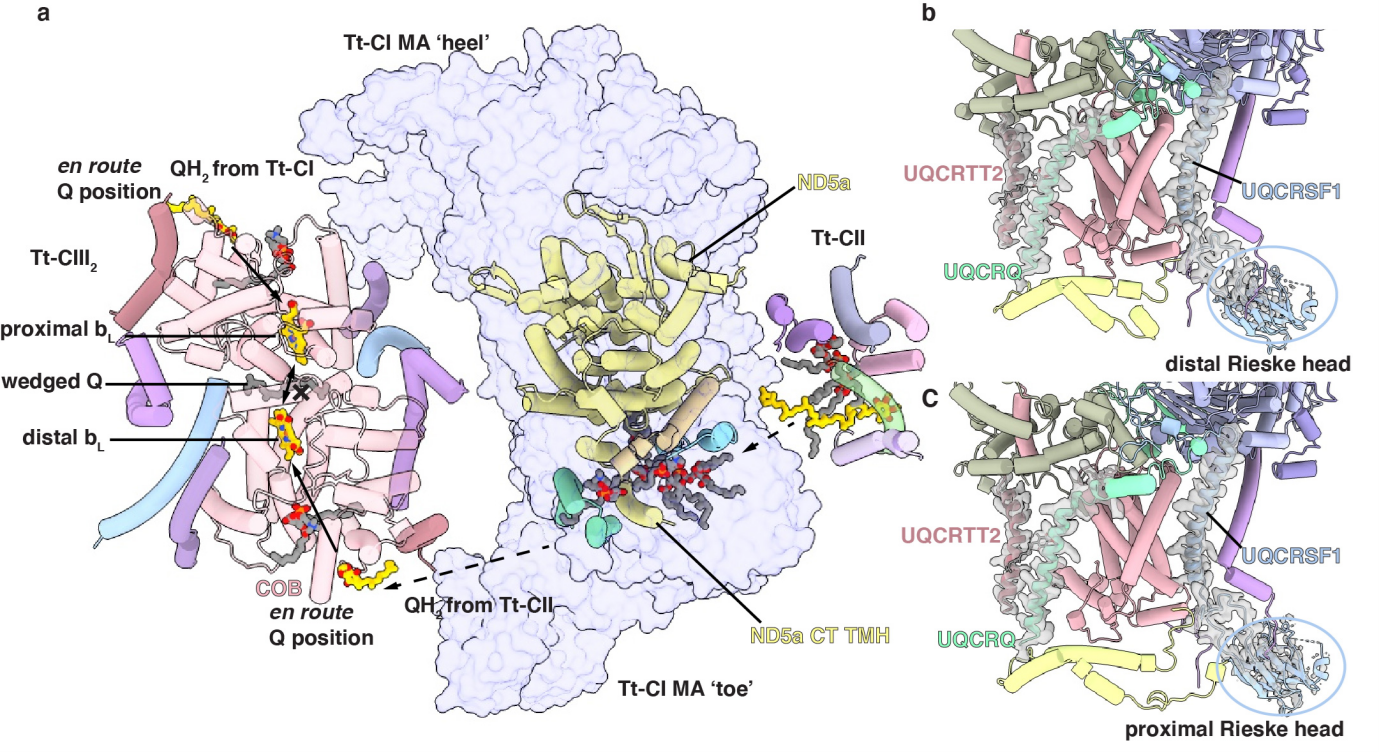
除以上发现外,本研究所获结构还对长期争论的超级复合物内部是否存在底物通道以及电子载体依赖于通道的穿梭提供了新的论据。作者前期报道的四膜虫SC I+III2结构显示,其强制二聚的CIII2远离CI CoQ通道一侧单体的UQCRFS1亚基Rieske head结构域密度清晰,而另一侧单体该结构域的密度则十分微弱,说明靠近CI的CIII单体Rieske head存在构象灵活性。值得注意的是,CIII2经典的醌循环工作机制指出,Rieske head结构域必须通过转动实现电子从CoQ氧化位点向下游电子载体细胞色素c的传递,这说明四膜虫SC I+III2中CIII2仅一侧单体具备电子传递活性,出现了所谓功能对称性的破坏。关于在真核生物各物种中保守存在的超级复合物SC I+III2形成的生理意义的假说之一,就是通过破坏CIII2的功能对称性以实现电子传递速率的控制。
令人惊讶的是,原本在四膜虫超级复合物SC I+III2中被破坏的CIII2对称性在超超级复合物MC IV2+(I+III2+II)2中得到了恢复,体现为此时两份Rieske head的密度均不清晰。考虑到超级复合物SC I+III2与超超级复合物MC IV2+(I+III2+II)2结构上的一个重要区别就是后者的形成有CII参与,一个令人振奋的假设是,四膜虫CIII2的两个单体分别负责接受来自CI和CII的电子,而实现这一工作机制的唯一可能性就是超超级复合物内部分别存在连接CI-CIII2和CII-CIII2的两条底物通道。在结构中确可看到,CI保守的核心亚基ND5在四膜虫CI中分裂成了ND5A和ND5B两个亚基,而四膜虫ND5A特有的C末端跨膜螺旋与其余跨膜区域形成填满磷脂的夹角,有利于来自CII,高度疏水的CoQH2直接穿过并到达CIII2远离CI单体的CoQ氧化位点。这提示了向来被驳斥的“底物通道”理论在四膜虫超超级复合物中可能成立。作者基于此进行了初步的动力学活性验证,而更明确的功能性证据则有赖于更加深入的实时血红素光谱动力学研究。
总而言之,本研究在前作(Zhou et al, Science 2022)基础上,以四膜虫为模式种,从结构和功能两方面进一步深入探究了真核生物呼吸链系统令人惊叹的进化多样性。一位匿名审稿人评论“该工作的视野令人印象深刻(The scope of the work is very impressive)”。本文的意义在于展示了呼吸链高级聚集形态的多样性部分源自于与线粒体嵴形态的协同进化。值得注意的是,在本文发表前亦有独立的类似研究(Mühleip et al, Nature 2023)得出了与本文基本一致的结论,但该文仅展示了四膜虫较小的超级复合物SC IV2+I+III2+II结构。
浙江大学基础医学院周龙研究员是本文通讯作者,浙江大学基础医学院研究助理韩芳竹、2022级博士生胡怡琦为本文共同第一作者,参与该文研究的还有浙江大学基础医学院博士生吴梦晨,何召祥与田红涛。本研究得到了浙江大学冷冻电镜中心与浙江大学医学院公共技术平台的大力支持,在此一并致谢。
原文链接:https://www.nature.com/articles/s41467-023-38158-5#citeas










