病毒感染因其所致传染性疾病多种多样,同时伴随着较高的发病率和死亡率,因此极大地威胁着人类的健康和生命。
I型干扰素(IFN-I)信号是机体抗病毒天然免疫应答的核心。病毒感染发生时,模式识别受体(PRRs)通过检测识别病毒核酸和蛋白成分,迅速启动下游抗病毒免疫反应,激活IFN-I信号并诱导干扰素刺激基因(ISGs)表达,发挥抗病毒效应,保护机体抵抗病毒入侵。抗病毒免疫应答受到机体的精准调控,但IFN-I信号通路如何调节抗病毒天然免疫应答,目前很大程度上依然未知。
2023年1月21日,浙江大学基础医学院免疫学研究所蔡志坚/王建莉课题组在《Cell Reports》在线发表题为Type I interferon/STAT1 signaling regulates UBE2M-mediated antiviral innate immunity in a negative feedback manner的文章。阐明了巨噬细胞的UBE2M在激活机体抗病毒感染过程中的重要作用,揭示了一条IFN信号通过抑制UBE2M水平,负反馈调节抗病毒免疫应答的新机制,并开发了一款以牛奶来源的胞外囊泡为递送载体,通过口服便可提高机体抗病毒免疫的新制剂。

作为胞浆中最重要的RNA病毒感受器,RIG-I在抗RNA病毒天然免疫应答过程中发挥着至关重要的作用。因此,阐明细胞内RIG-I信号通路的调控机制具有重要意义。本研究前期通过分析细胞中RIG-I的互作蛋白,筛选出UBE2M分子可能作为RIG-I潜在的调控蛋白。
通过一系列体内、外实验,课题组发现,巨噬细胞的UBE2M可以正向调节RIG-I介导的IFN-I信号。UBE2M通过直接结合RIG-I,抑制RIG-I与其E3泛素连接酶STUB1之间的互作,从而抑制RIG-I的蛋白酶体降解,增加胞内的RIG-I蛋白水平,从而促进巨噬细胞分泌IFN-I。同时,RNA病毒感染以IFN/STAT1信号依赖的方式抑制巨噬细胞UBE2M的表达。病毒感染通过激活的STAT1信号直接促进E3连接酶Trim21的转录,而TRIM21作为UBE2M的E3泛素连接酶介导UBE2M降解,进而抑制了由UBE2M介导的IFN-I的产生,形成一个负反馈调节环路。为实现该研究发现的转化应用,作者将缺乏E3连接酶活性的TRIM21(TRIM21-ΔRING)装载于牛奶来源的胞外囊泡(mEVs)上。口服这些mEVs可有效将TRIM21-ΔRING递送至肺脏和肝脏巨噬细胞,TRIM21-ΔRING通过与TRIM21竞争性结合UBE2M,显著抑制TRIM21介导的UBE2M蛋白降解,从而增强了机体的抗病毒免疫并加速了病毒的清除。
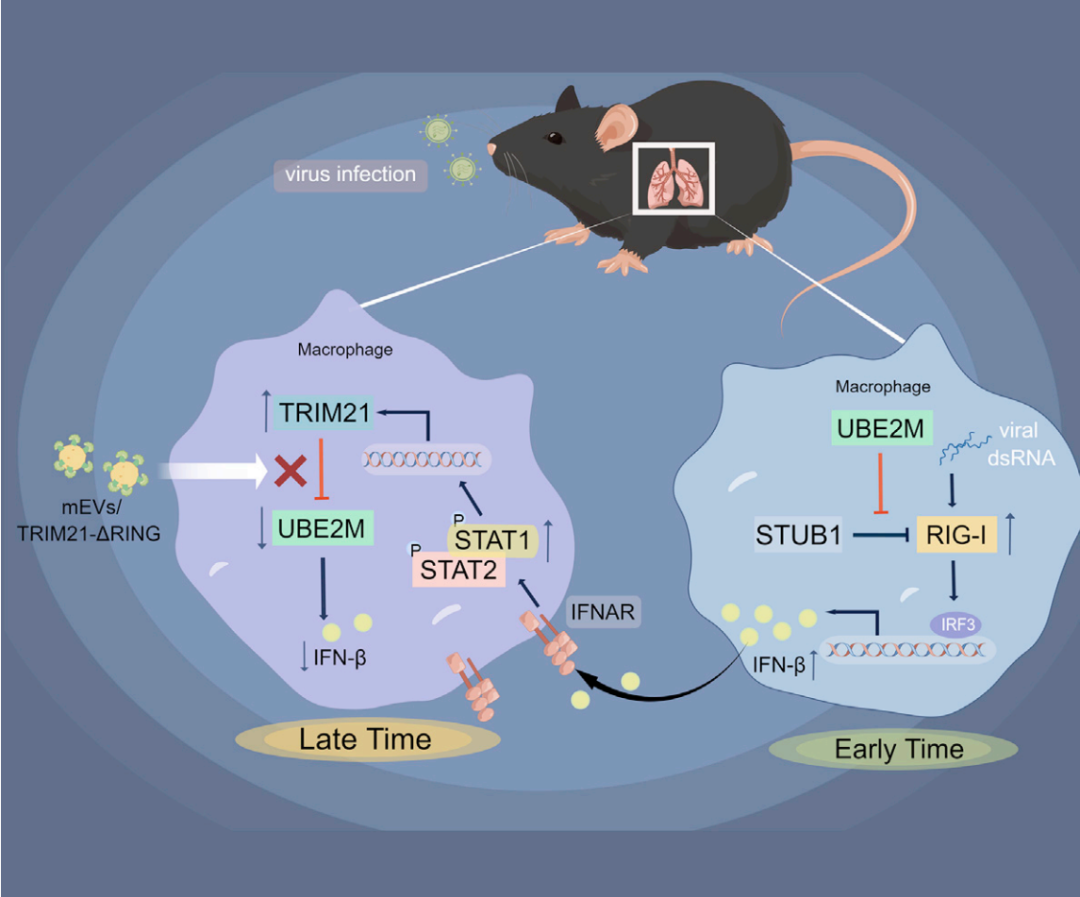
综上所述,本研究表明巨噬细胞UBE2M在抗RNA病毒天然免疫应答的调节过程中发挥了不可忽视的作用,揭示了一条IFN-I信号通过调控UBE2M表达,负反馈调节抗病毒免疫的新机制,并概念验证了装载mEVs的TRIM21-ΔRING是有效的抗病毒制剂,其与牛奶相同的口服方式提示该制剂的安全性,具备较高的转化前景。
浙江大学基础医学院蔡志坚教授、浙江大学附属第二医院重症医学科张根生教授、浙江大学基础医学院王建莉教授和卢信良博士后为论文的共同通讯作者。浙江大学基础医学院博士研究生孔祥辉、博士后卢信良和博士研究生王识博为论文的共同第一作者。
原文链接:
http://doi.org/10.1016/j.celrep.2023.112002










