G蛋白偶联受体(G protein Coupled Receptor)是一类具有七次跨膜螺旋的膜受体蛋白,几乎参与了所有的生理和病理过程,因而GPCR也是关键的药物靶点,目前近40%FDA批准的药物是靶向GPCR发挥药效。人体826种GPCR绝大多数是通过单体发挥作用的,然而C型GPCR是明确通过受体的二聚化发挥生理作用的。该家族成员主要包括代谢型γ-氨基丁酸受体GABAB、代谢型谷氨酸受体mGlu、钙敏感受体CaSR和味觉受体I等,参与众多神经和精神疾病,包括癫痫、疼痛、焦虑、抑郁、精神分裂症、药物成瘾、Rett综合征和癫痫性脑病等。
神经递质γ-氨基丁酸(GABA)是哺乳动物中枢神经系统中重要的抑制性神经递质,约30%的中枢神经突触部位以GABA为传递物质。GABA主要通过离子通道型GABAA受体和代谢型GABAB受体介导中枢神经系统的抑制性神经传递。GABAB受体由GB1和GB2两个亚基组成。每个亚基又分别由内源性配体结合的胞外结构域(VFT),七次跨膜区(TM)和胞内区构成。
靶向GABAB受体乃至整个C型GPCR家族的药物发现困难重重,主要原因是由于激动剂小分子对正构结合口袋的选择性较低,易脱靶作用于GABAA受体以及其他单胺类神经递质受体。目前仅有2个小分子药物(baclofen (Lioresal®),γ-hydroxybutyrate (GHB))被批准分别用于治疗肌肉痉挛、发作性睡。因而,变构调节剂的研发一直广受关注。正向变构调节剂rac-BHFF(BHFF外消旋形式)、CGP7930等能够显著增强GABAB受体的下游信号。虽然这类分子展现了巨大的潜力,但是其活性均较低,需要进一步优化。由于缺乏受体结构药理学研究提供的受体与变构活性分子相互作用模式,导致正向变构药物研发一直没有突破性的进展。因而高分辨率C型GPCR,尤其是GABAB受体的全长结构解析一直是相关研究的重点和热点。由于GABAB受体复合物组装以及结构解析方面存在巨大的困难,这使得多年来GABAB受体激活以及识别变构调节剂的结构基础一直未被揭示,阻碍了人们认识GABAB受体激活过程中不同功能域的构象变化,G蛋白的结合方式,以及变构调节剂结合位点,延缓了靶向GABAB的药物研发。
2020年6月3日,浙江大学基础医学院生物物理学系、医学院附属邵逸夫医院、教育部脑与脑机融合前沿科学中心以及浙江省免疫与炎症疾病重点实验室张岩课题组与华中科技大学生命科学与技术学院刘剑峰课题组联合在Cell Research以Article形式在线发表了题为Cryo-EM structures of inactive and active GABAB receptor的文章。该研究国际上首次报道了人源全长异源二聚体GABAB受体的精细三维空间结构,具体包括:高分辨的拮抗剂结合的受体结构;高分辨的激动剂与正向变构调节剂(BHFF)同时结合的受体结构;以及与G蛋白偶联的三种不同状态的GABAB-Gi1复合物结构。该发现阐明了GABAB受体的激活机制,发现了正向变构调节剂的结合口袋,为今后靶向GABAB受体的药物研发奠定了基础。
在该工作中,文章作者首先尝试多种表达方案,确定了合适的表达纯化体系并获得了高质量的蛋白样品,最终通过冷冻电镜技术成功解析了GABAB受体在非激活状态和激活状态-Gi1蛋白复合物的高分辨结构,分辨率为2.8 Å 和3.0 Å。该结构不仅可以清楚的确定GABAB受体的非激活和激活的状态;同时,高质量的密度也展示了拮抗剂、激动剂、正向变构调节剂的结合口袋。有意思的是,虽然在结构研究中使用了外消旋形式的变构调节剂BHFF(即(+/-)-BHFF两种化合物的混合物;市场上唯一可购买的形式,一直被用于动物和细胞研究),但是高分辨率的电镜密度图清晰地显示只有(+)-BHFF结合在异源二聚体跨膜区界面上,为进一步优化变构调节剂明确了方向,展示了结构药理学在药物发现中的强大作用。
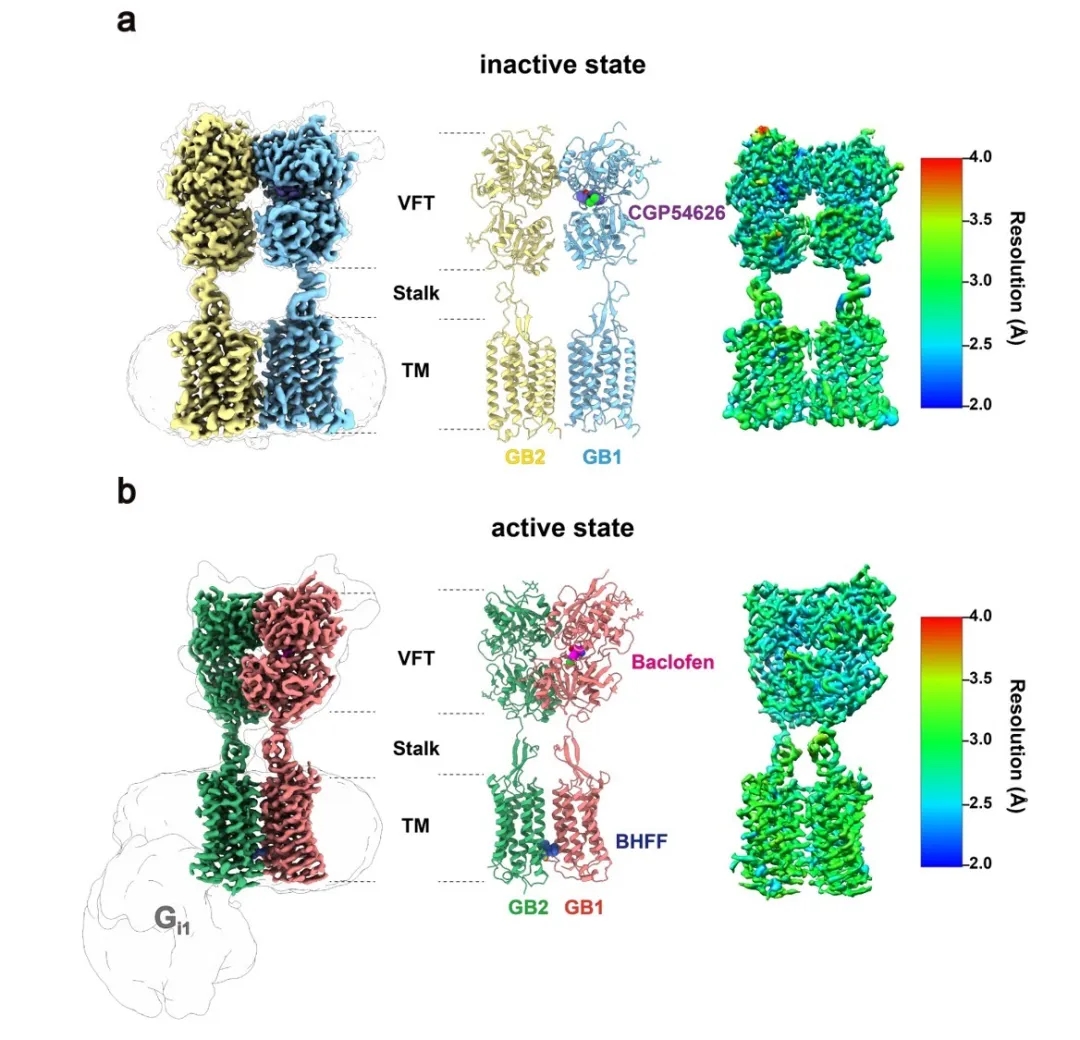
图1.展示了GABAB受体的高质量的电镜结构,整体分辨率在2.5-3.0 Å。(a):GABAB受体的非激活状态。(b):GABAB受体的激活状态。CGP54626为GABAB的拮抗剂,baclofen是激动剂,BHFF为正向变构调节剂。
GABAB受体在非激活状态时GB1和GB2的VFT都处于打开状态,TM区的相互作用界面处于GB1和GB2的TM3-TM5/TM3-TM5交接处。激动剂的结合引起了GB1的VFT关闭,进而诱导了两个亚基之间的TM界面重排,使得TM从非激活状态的TM3-TM5/TM3-TM5界面转换到激活状态的TM6/TM6界面。
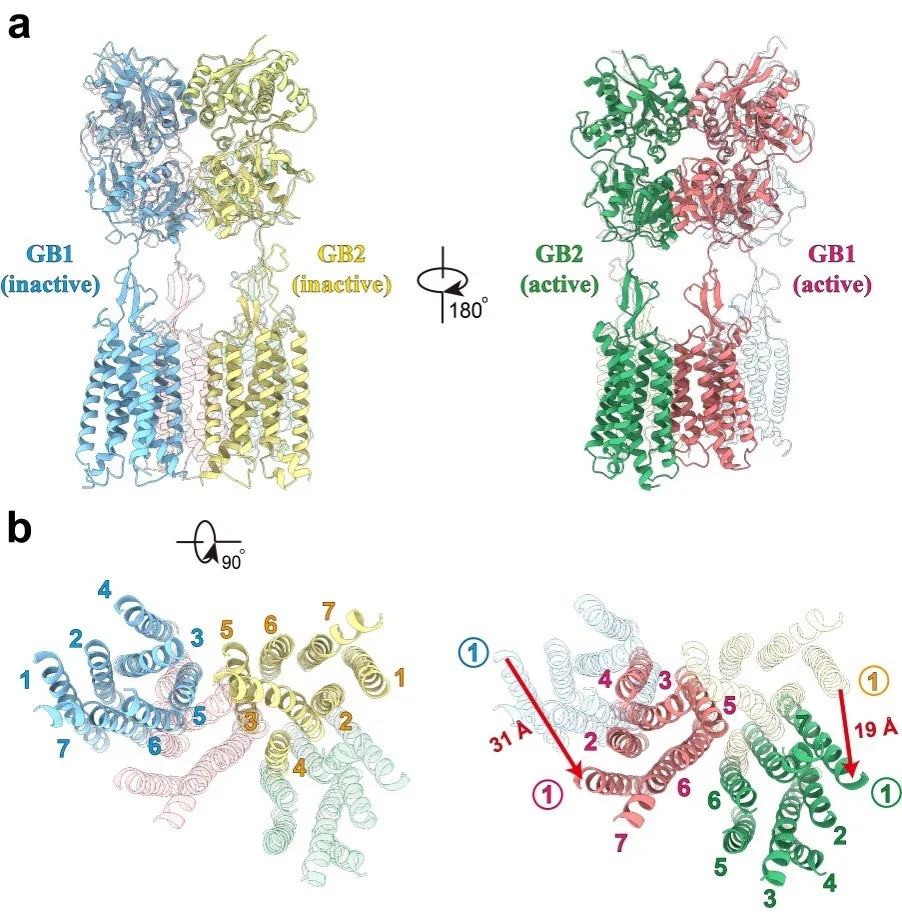
图2.GABAB受体在非激活和激活状态界面。当受体被激活时,GABAB的相互作用界面发生了重排,其TM的界面从TM3-TM5/TM3-TM5界面转换到TM6/TM6界面。
为进一步揭示GABAB受体的激活机制,作者深入分析了不同状态下的相互作用界面。在靠近TM3与TM5的底部,保守的带电荷残基H3.55和E5.60形成了离子键,稳定了非激活的状态。在TM3-TM5/TM3-TM5界面的上端存在一个较深的缝隙可能被3个胆固醇占据,中部间隙被另外2个胆固醇占据,稳定了受体处于非激活状态。处于激活状态的受体由两个亚基的TM6通过疏水相互作用形成了稳定的相互作用界面,并在TM6的中间位置由Y6.44和N6.45形成了一个氢键网络。作者还发现,GABAB受体无论是处在激活状态还是非激活状态,GB1和GB2亚基跨膜结构域中靠近胞外的口袋都被磷脂占据,并推测该磷脂的存在可能是受体必需的结构组会。综上,本研究工作解析了全长GABAB异源二聚体处于非激活和激活状态的原子分辨率结构,为靶向GABAB的药物开发提供了精确的三维空间结构信息,将加速GABAB药物的研发。
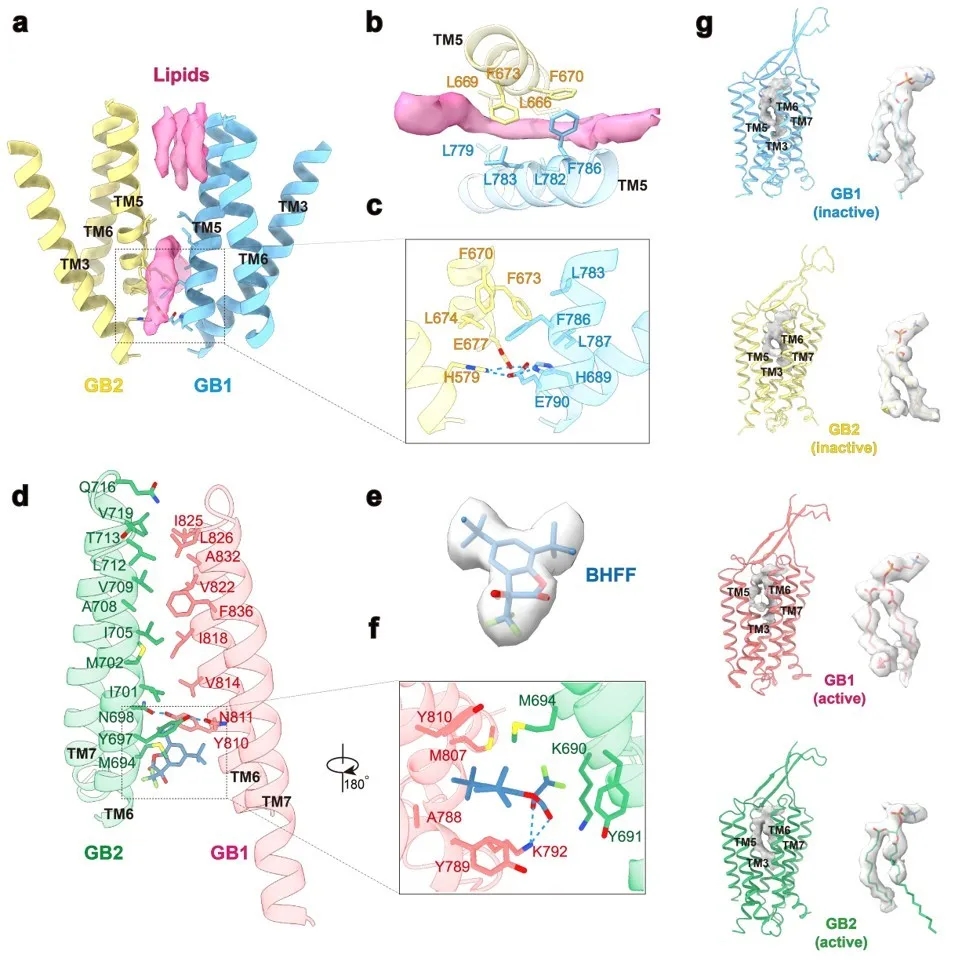
图3.GABAB受体在非激活和激活状态的相互作用界面。(a-c):GABAB受体的非激活状态处于TM3-TM5/TM3-TM5的界面,在界面的TM上端的口袋由三个胆固醇插入稳定了非激活状态。(d-f)GABAB受体的激活状态处于TM6/TM6的界面,及其PAM结合口袋处于GB1、GB2的TM之间。(g):磷脂存在GB1和GB2的TM中间。
此外,本工作通过对GABAB-Gi复合物研究发现了三种G蛋白偶联形式,其中两种与GB2结合(B2a,B2b状态),一种与GB1结合(B1状态)。结构分析发现由于空间位阻的原因,导致GABAB受体一次仅能结合一个G蛋白。GABAB受体的激活诱导了GB2 TM区的胞内环3(ICL3)的开放以及TM3、4、5的协同位移从而适应Gi蛋白α5结构域的结合。通过对第一个异源二聚体GPCR结构的解析,作者展示了新颖的GPCR激活机制。GABAB受体与G蛋白的结合与A、B、F型的GPCR单体结合G蛋白的方式存在较大的差异,从而揭示了二聚化GPCR结合G蛋白的新偶联机制,在理解二聚化乃至多聚化GPCR的激活机制以及与G蛋白偶联等方面起到了积极促进作用。
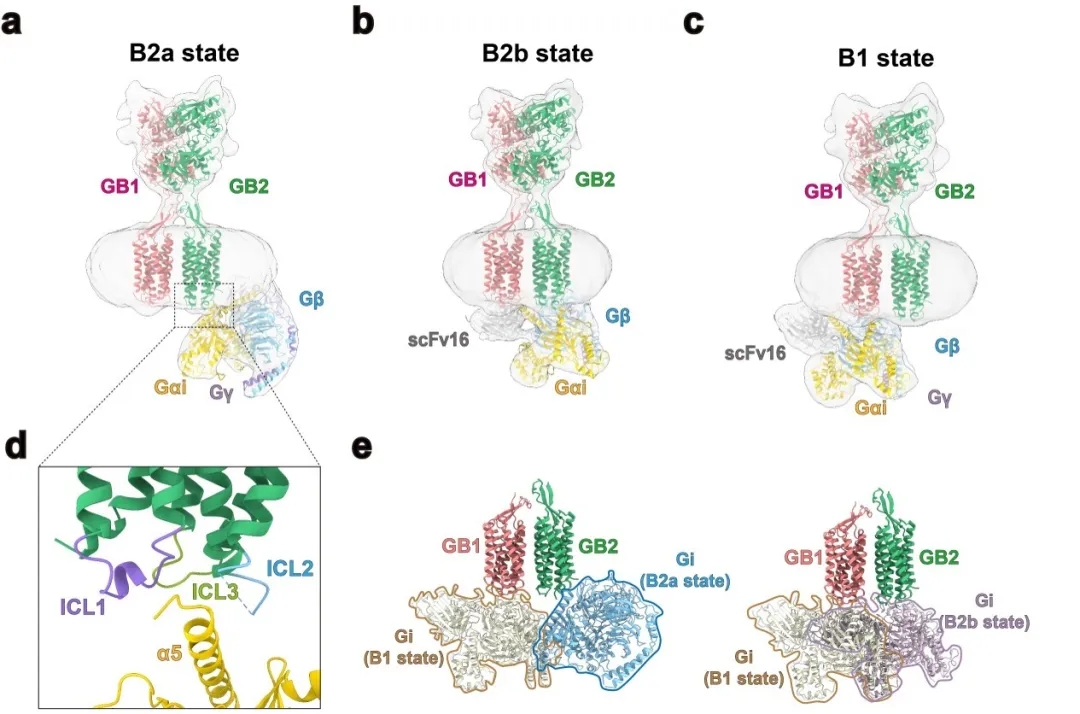
图4. (a-c):GABAB-Gi1复合物存在B2a、B2b、B1三种不同的状态。其中有两种状态的G蛋白偶联在GB2亚基,一种状态的G蛋白偶联在GB1亚基。(d):GABAB受体的激活TM6没有明显外扩,其Gi-α5与GABAB受体的界面主要在loop区。(e):由于存在来自于G蛋白的空间阻碍,GABAB异源二聚体在激活时只能结合一个G蛋白。
浙江大学基础医学院博士后毛春友、浙大-华科大联合培养博士生申仓松为共同第一作者;本研究所需样品均在浙江大学医学院蛋白质平台优化制备,平台负责人马骋博士给予了大量协助;浙江大学冷冻电镜中心常圣海博士为本次研究的电镜数据收集提供了支持。张岩研究员和刘剑峰教授为本论文共同通讯作者。










