血液系统肿瘤是最常见的恶性肿瘤之一,也是影响人们健康的重要疾病。恶性血液系统疾病起源于造血系统,常见血液肿瘤主要有白血病、淋巴瘤、骨髓增殖性肿瘤、多发性骨髓瘤等。由于表征繁复、分型多样,血液系统肿瘤具有早诊率低、复杂难治等特点。数十年来,造血干细胞移植、化疗、放疗、靶向治疗(酪氨酸激酶抑制剂等)与细胞免疫治疗(CART治疗等)的发展和临床应用为一些特定类型的血液系统肿瘤的治疗带来了巨大变化。然而每种疗法只对部分恶性血液疾病有效、且治疗后复发率高,因此,针对不同类型的血液系统肿瘤仍需开发特定的治疗方案。
2022年9月26日,浙江大学基础医学院/良渚实验室钱鹏旭课题组联合国家纳米科学中心陈春英研究员在《Nature Communications》杂志在线发表了题为“Graphdiyne oxide nanosheets display selective anti-leukemia efficacy against DNMT3A-mutant AML cells”的研究论文,首次报道了氧化石墨炔(GDYO)对DNMT3A突变型AML细胞的特异性杀伤作用及相关机制。

突变导致的基因功能异常通常是急性髓系白血病(AML)发病的分子基础,流行病学统计表明AML中约20%为DNA甲基转移酶3A(DNMT3A)突变型,而DNMT3A突变通常与AML患者较短的总生存期和无复发生存期相关。目前临床上对伴有DNMT3A突变的成年AML患者通常将去甲氧柔红霉素(IDA)或柔红霉素(DNR)与阿糖胞苷(Ara-C)组成的IA/DA“3+7”方案作为一线化疗方案。虽然总体而言DNMT3A突变型AML患者的完全缓解率和DNMT3A野生型患者相比并无统计学差异,但复发率高、预后差,有报道也指出DNMT3A突变会导致核小体重构从而促进白血病细胞对蒽环类药物的耐药性。近年来针对DNMT3A突变型AML开发了其他小分子靶向药物,包括DNA甲基转移酶酶活性的小分子抑制剂,如5-氮杂胞苷和地西他滨;或者抑制DNMT3A突变异常上调的靶点和/或信号通路,如组蛋白赖氨酸甲基转移酶(DOT1L)抑制剂,但临床结果仍需进一步研究。在此背景下,提高对DNMT3A突变型AML细胞基本生物学功能的理解并针对性的开发治疗方法是一种新型研究策略。
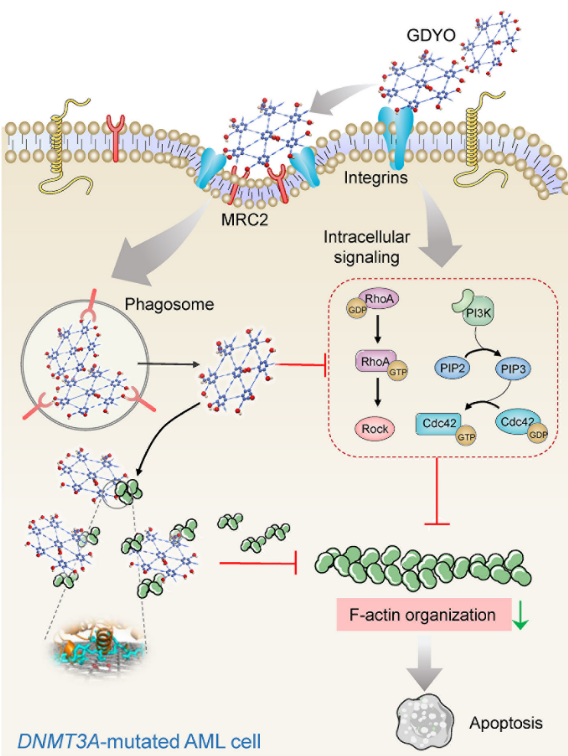
本研究发现和DNMT3A野生型AML细胞相比,DNMT3A突变型AML细胞中粘附相关基因高表达且显示出高粘附的表型。由于碳纳米材料可以调节细胞粘附并引导细胞命运,研究人员筛选了多种一维和二维的碳材料并意外地发现GDYO对DNMT3A突变型AML细胞显示出极强的杀伤作用,对DNMT3A野生型AML细胞却几乎无毒性。GDYO由于其独特的理化性质,特别是相较于GO更好的亲水性和更强的片间静电斥力,使得其具有更好的生物活性。
然而,鉴于GDYO只针对DNMT3A突变AML细胞具有选择性作用,而不是对所有测试的细胞都具有普遍活性,因此还有其他细胞特异性的因素会影响GDYO的生物活性。研究人员通过分析GDYO结合蛋白质组发现GDYO和两种在DNMT3A突变AML细胞高表达的膜蛋白ITGB2、MRC2特异性结合,从而增加DNMT3A突变AML细胞对GDYO的摄入。进入细胞后GDYO通过和actin的直接作用干扰F-actin细胞骨架的正常组装,最终导致细胞死亡。最后,研究人员还验证了GDYO对DNMT3A突变AML的体外治疗效果及GDYO的生物安全性。
浙江大学基础医学院/良渚实验室博士后王琪炜为本文的第一作者,国家纳米科学中心刘颖研究员、王会副研究员及良渚实验室博士后姜蓬垒和钱文畅为该工作的共同第一作者。浙江大学基础医学院/良渚实验室钱鹏旭研究员和国家纳米科学中心陈春英研究员为通讯作者。
原文链接:
https://www.nature.com/articles/s41467-022-33410-w
同期,钱鹏旭研究员课题组与国家纳米科学中心刘颖研究员共同通讯在《Nano Today》杂志上在线发表了题为“Graphdiyne oxide nanosheets exert anti-lymphoma effect by killing cancer stem cells and remodeling tumor microenvironment”的研究论文,报道了GDYO通过杀伤肿瘤干细胞和重塑肿瘤微环境治疗B细胞淋巴瘤。
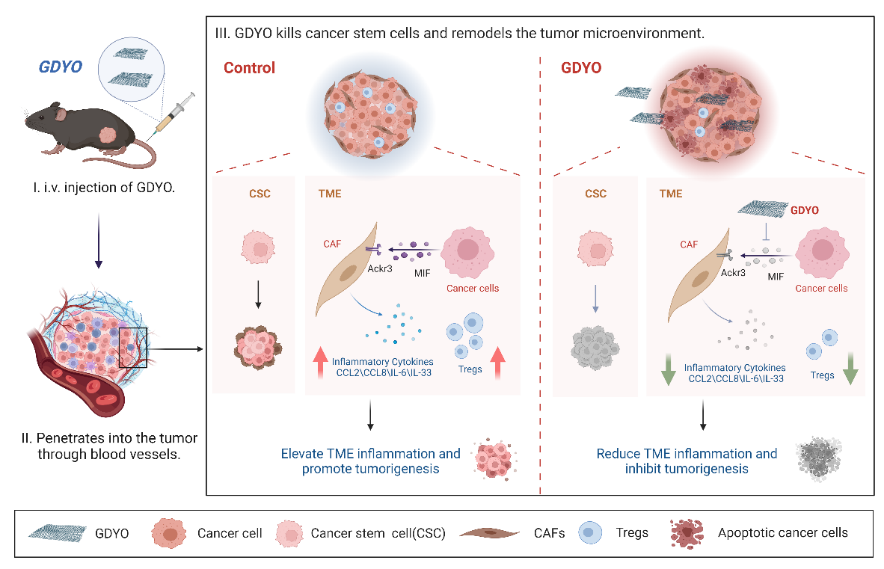
与白血病不同,淋巴瘤是一类起源于淋巴系统的实体肿瘤。此外基于实体肿瘤的“种子土壤”学说,肿瘤干细胞和肿瘤微环境的复杂的动态调控网络与共同进化为肿瘤的起始、生长、免疫逃逸及耐药提供了条件。临床上针对CD20阳性的弥漫大B细胞非霍奇金淋巴瘤(DLBCL)使用Rituximab单抗药物联合标准CHOP化疗(环磷酰胺、多比柔星、长春新碱、泼尼松),缺乏同时杀伤肿瘤干细胞并重塑微环境的治疗方式。

已有研究表明GDYO可以通过改善肿瘤乏氧微环境、调节肿瘤巨噬细胞的表型等方式重塑肿瘤微环境。在本项研究中,研究人员首先发现B细胞淋巴瘤具有免疫抑制和炎症微环境,并且GDYO对多种淋巴瘤细胞均显示出直接的体外杀伤效应。通过对荷瘤小鼠注射GDYO治疗,能够显著抑制B细胞淋巴瘤的生长并降低肿瘤细胞的数目。随后研究人员通过单细胞转录组学深入探究了GDYO对B细胞淋巴瘤的治疗机制:GDYO治疗显著减少了肿瘤干细胞的数量,并降低了从肿瘤细胞到肿瘤相关成纤维细胞(CAFs)的MIF-Ackr3信号水平,导致微环境中CAFs分泌的炎症因子和Treg数目的下降,从而改善免疫抑制和炎症微环境。
浙江大学基础医学院干细胞与再生医学研究中心博士生李金鑫、博士后王琪炜和鲁欢及博士生韩颖丽为此工作的共同第一作者。浙江大学基础医学院/良渚实验室钱鹏旭研究员和国家纳米科学中心刘颖研究员为通讯作者。以上两个工作研究得到中科院化学研究所李玉良院士、刘辉彪研究员,国家纳米科学中心赵宇亮院士、施兴华研究员的支持。同时感谢浙江大学冷冻电镜中心和医学院公共技术平台的支持。
上述研究旨在针对不同类型的血液系统肿瘤开发特定的治疗策略。DNMT3A突变型AML细胞高粘附的特征与恶性程度、高复发、预后差等密切相关,作者利用了这一特征,筛选发现GDYO可以增强对其相互作用从而杀伤AML细胞,实现对白血病细胞的“以毒攻毒”。B细胞淋巴瘤具有免疫抑制和炎症微环境,并通过与肿瘤干细胞的相互作用提高治疗难度,GDYO可以对种子(肿瘤干细胞)和土壤(肿瘤微环境)进行双重打击,实现淋巴瘤治疗的“一石二鸟”。
原文链接:
https://linkinghub.elsevier.com/retrieve/pii/S174801322200250X
此前,钱鹏旭研究员课题组与浙江医学院附属第一医院/良渚实验室黄河教授合作在《Leukemia》杂志上在线发表了题为“Single-cell ATAC-seq maps the comprehensive and dynamic chromatin accessibility landscape of CAR-T cell dysfunction”的研究论文。该研究利用scATAC-seq技术在单细胞水平描绘了在体外培养和多发性骨髓瘤病人体内的CAR-T细胞在杀伤肿瘤细胞过程中的染色质可及性动态变化。

CART细胞治疗在多种恶性血液肿瘤中都取得了良好的治疗效果,但也存在一些不良反应和弊端,例如体内持久性差、易复发、不能有效扩增、靶抗原丢失或突变、细胞因子综合征等。在临床肿瘤治疗中,CART细胞耗竭是一种影响细胞增殖和体内维持的重要因素,这也是导致肿瘤杀伤效果差和肿瘤复发的重要原因。因此,减缓CART细胞耗竭速度、延长初始(naive)T细胞和记忆(memory)T细胞在体内的维持时间,将有助于提高CART疗法的治疗效果。
本研究为了探索表观遗传调控在CAR-T细胞分化、耗竭过程中的调控机制,研究团队利用scATAC-seq检测了CAR-T细胞在肿瘤抗原刺激过程中的染色质可及性动态变化,并根据耗竭相关受体的染色质可及性差异,定义了两个耗竭细胞亚群:中间耗竭T细胞和终末耗竭T细胞,并构建了CAR-T细胞从初始T细胞、效应T细胞、中间耗竭T细胞、终末耗竭T细胞的发育轨迹。中间耗竭T细胞特异升高的染色质可及区域中显著富集了JUN、FOS、NFKB1、BACH2等转录因子的motif,而在终末耗竭T细胞中显著富集了BATF、IRF4、PRDM1等转录因子的motif。考虑到BATF和IRF4在终末耗竭中会出现特异激活,并且TOX、CTLA4等关键耗竭相关基因座附近的差异染色质可及性区域中存在BATF和IRF4的motif,所以BATF和IRF4可能特异的在终末耗竭CAR-T细胞中发挥重要作用。功能验证实验进一步证实抑制BATF和IRF4的表达可以有效增强CAR-T细胞的存活、提高抗肿瘤活性。
该研究在单细胞水平描绘了CART细胞杀伤、耗竭过程中的染色质可及性动态变化图谱,完善了CART细胞耗竭的表观遗传调控机制,为研究者探索CAR-T细胞的表观遗传特征提供了重要的数据资源。另外对体内、外CAR-T细胞耗竭相关转录因子的探索,也为临床改造CART细胞以实现更好的治疗效果提供新的思路。
良渚实验室博士后姜蓬垒、张召茹、浙江大学医学院附属第一医院胡永仙主任、博士研究生梁祖宇为本文共同第一作者。浙江大学基础医学院/良渚实验室钱鹏旭研究员、浙江大学医学院附属第一医院/良渚实验室黄河教授为本文的共同通讯作者。
原文链接:
https://www.nature.com/articles/s41375-022-01676-0
实验室简介
钱鹏旭,浙江大学基础医学院研究员,国家高层次青年人才项目入选者,国家自然基金委优秀青年基金获得者,国家重点研发计划“干细胞及转化研究”青年项目首席科学家,浙江省杰青项目入选者。
研究方向为造血干细胞和CAR-T等治疗性血细胞功能的调控机制研究,近5年以通讯/第一作者在Lancet Haematology, Cell Stem Cell, Cell Research等杂志发表SCI论文31篇。
现因发展需要,诚邀博士后和科研助理加入,有意者请将简历发送至[email protected]。












