2022年7月25日,浙江大学基础医学院/浙江大学医学院附属邵逸夫医院冯钰课题组在Nucleic Acids Research在线发表了题为“Structural basis of AlpA-dependent transcription antitermination”的研究论文,揭示了铜绿假单胞菌AlpA蛋白拮抗转录终止的机制。
铜绿假单胞菌(Pseudomonas aeruginosa)是一种条件致病菌,也是医院内感染的主要病原菌之一,是囊性纤维化患者发病和死亡的主要原因。AlpA蛋白通过发挥转录抗终止活性,能够正向调控与铜绿假单胞菌毒性相关的程序性细胞死亡通路。AlpA蛋白特异地识别并结合alpB启动子上的ABE序列,然后结合到启动子处的RNA聚合酶上,使其能够通读启动子下游的转录终止序列而不发生转录终止。
噬菌体Q蛋白是分子生物学教科书里抗终止蛋白的经典范例,课题组曾在Nature Communications发文揭示21Q的抗终止机制——两个21Q蛋白均结合启动子DNA和RNA聚合酶,其中一个21Q蛋白的N端形成环状结构并深入RNA通道内抑制发卡结构的形成,从而拮抗转录终止。
该研究首次在体外验证了AlpA蛋白的转录抗终止活性,并成功组装了依赖AlpA的转录抗终止复合物。利用冷冻电镜单颗粒重构技术,研究分别解析了AlpA在启动子处装载的复合物结构(AlpA-loading complex)以及AlpA发挥抗终止功能的复合物结构(AlpA-loaded complex)。结构显示,AlpA通过C端的螺旋-转角-螺旋模体识别启动子DNA,AlpA的N端形成一个环状结构并深入RNA通道内,新生RNA从这个环里穿过。
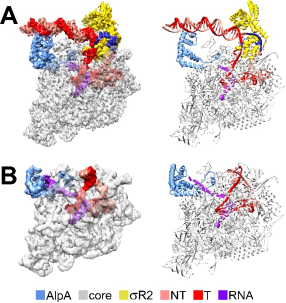
图1 AlpA抗终止复合物的冷冻电镜结构
(A) AlpA-loading complex的电子云(左)和结构模型(右); (B)AlpA-loaded complex的电子云(左)和结构模型(右)
与21Q不同的是,只有一个AlpA分子结合启动子与RNA聚合酶。与21Q相同的是,二者都缩小RNA通道的口径,阻碍发卡结构的形成,进而达到抗终止的目的。通过比较AlpA和21Q的冷冻电镜结构,以及AlphaFold预测的Q家族其它两个经典抗终止蛋白λQ和82Q的结构,研究发现尽管这些蛋白没有序列相似性,却具有相似的结构。因此,研究推测它们都通过相似的机制发挥转录抗终止功能。
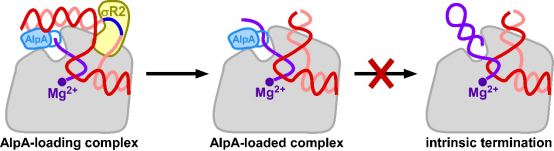
图2 AlpA的抗终止机制
浙江大学医学院博士研究生温瑷嘉、主治医师赵敏星、硕士研究生金莎为该研究的共同第一作者,浙江大学医学院冯钰研究员和陆远强教授为该研究的共同通讯作者。该研究的冷冻电镜工作全部在浙江大学冷冻电镜中心完成,也得到了浙江大学冷冻电镜中心高性能计算平台和医学院蛋白质平台的支持。
原文链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkac608/6649382












