生物大分子的相分离和相变是一个高速发展的前沿科学领域。重要蛋白在细胞内发生的液-液相分离(Liquid-liquid phase separation)不仅能够形成无膜细胞器,还能组装成信号体(Signalosome)。这类信号体不受膜的束缚,可以和细胞质内的信号分子发生快速的信号交换,还能够在特定的胞内区域提升蛋白浓度和信号强度。Wnt、TCR、Hedgehog等信号通路相继被国外研究组发现存在相分离现象。但作为调控机体生长和代谢的重要通路,胰岛素/IGF信号是否存在相分离现象尚未被揭晓。
2022年6月28日,浙江大学基础医学院周以侹/郑莉灵课题组在《Cell Discovery》杂志在线发表了题为“Phase separation of Insulin Receptor Substrate 1 drives the formation of insulin/IGF-1 signalosomes”的研究论文,揭示了支架蛋白IRS1通过发生相分离,来组装出无膜包裹的信号体,从而促进胰岛素/IGF信号的传导。
周以侹/郑莉灵课题组2020年发表在《Cell Death and Differentiation》上的文章揭示了Rab5和IRS1之间发生互作,从而促进肌肉再生和胰岛素/IGF信号。在该研究中,我们发现IRS1会形成独特的点状聚集结构。
课题组高修奎博士在此基础上,借助光电联合显微镜技术,揭示IRS1的点状结构是不被细胞内膜包裹的液态体。我们利用细胞内和体外相分离技术,确认IRS1能够借助其内在无序区(intrinsically disordered region)发生相分离。重要的是,IRS1的相分离结构能够招募p85 和Grb2等下游效应因子,来组装出信号体,促进胰岛素/IGF信号的传导。
![]()
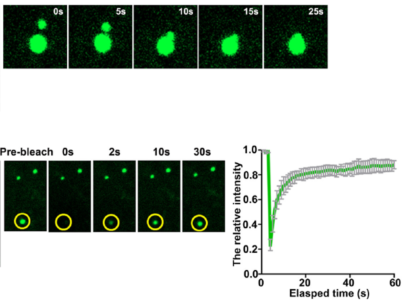
图1 IRS1蛋白的点状结构呈现液滴的特征
相分离的异常会导致多种神经退行性疾病、发育障碍和癌症发生。早在30年前,《Lancet》文章报道IRS1的G972R突变与代谢性疾病相关。课题组对此突变的相分离能力进行分析,发现G972R突变会削弱IRS1的分子内互作,从而削弱其相分离的形成,并影响胰岛素/IGF信号的下游传导。这一研究首次揭示了支架蛋白IRS1介导的相分离在调控胰岛素/IGF信号中的关键作用,为代谢性疾病相关突变的致病机理提供了可信的解释,也为开发代谢紊乱疾病的新治疗手段提供了潜在的干预靶点。
该课题的开展受到基础医学院孙启明等教授、电镜中心吴航军、郭建胜、韩琴老师,以及公共技术平台的肖桂凤、刘双双、林赵肖楠、宣君丽等老师的大力支持。本论文主要工作由生物化学系博士后高修奎完成,博士后饶锡生、从晓霞和博士生盛祖康为共同第一作者,课题组郑莉灵副教授和浙一医院呼吸科鲍彰副主任医师为共同通信作者。本研究受到基金委重大研究计划、创新研究群体、重点研发计划、浙江省自然科学基金重点项目和博士后研究基金等项目的资助。
原文链接:https://www.nature.com/articles/s41421-022-00426-x
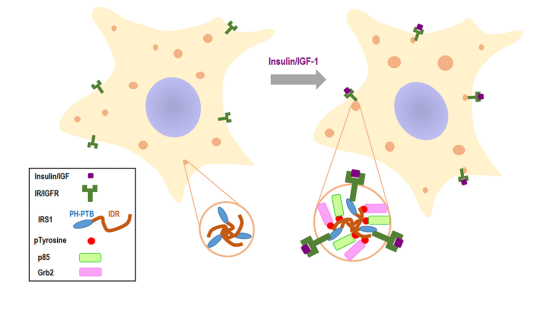
图2 本研究提出的模式图
课题组简介
周以侹/郑莉灵团队课题组的主要研究方向为肌肉骨骼系统的代谢、疾病与再生机制。
近期聚焦于:
1. 生物大分子相分离(phase separation)在代谢性疾病中的功能与机制;
2. 代谢重塑(metabolic reprogramming)对细胞命运的调控机理。
课题组链接:https://person.zju.edu.cn/zhouyiting
本团队有博士生导师两人,2022年计划招收博士生1-2人,欢迎具备保送生资格的考生咨询;团队也正在招收科研助理和博士后研究员。简历请发送至:[email protected]或[email protected]。












