浙江大学遗传学研究所古莹研究员团队与City of Hope 黄文栋教授团队合作,于2022年5月20日在Nature Communications在线发表了题为“Inhibition of the CDK2 and Cyclin A complex leads to autophagic degradation of CDK2 in cancer cells”的研究论文。该研究揭示了CDK2蛋白的自噬降解机制,并为治疗依赖CDK2的癌症提供了一条潜在的途径。

细胞周期与肿瘤关系密切,细胞周期蛋白依赖性激酶(cyclin-dependent kinases, CDKs)是一类调控细胞周期进程的丝氨酸/ 苏氨酸家族蛋白激酶。其中成员CDK2主要通过与Cyclin E和Cyclin A分别形成复合物以调控细胞周期中G1期到S期的转变以及S期的推进。CDK2在许多人类肿瘤中存在高表达和异常活化的现象,是治疗肿瘤的潜在靶点。但大多数传统的CDK2的抑制剂为ATP竞争性抑制剂,对CDKs家族其他成员的选择性不高,都止步于临床试验。因此开发高特异性的新型 CDK2 小分子抑制剂是目前亟需解决的问题。
在该项研究中,作者通过CavityPlus软件分析确定了位于CDK2/Cyclin A之间蛋白-蛋白互作界面(PPI)的两个非ATP结合位点的可成药口袋,并运用内部研发的LIVS pipeline对FDA批准的1952个小分子药物进行虚拟筛选,预测出对该PPI位点具有高亲和力的候选小分子药物列表。然后通过DARTS等方法进行验证,明确了高三尖杉酯碱(HHT)能结合CDK2的PPI位点,破坏CDK2和Cyclin A之间的相互作用,导致CDK2活性的丧失以及蛋白的降解,并在一系列细胞实验和动物实验中得到证实。
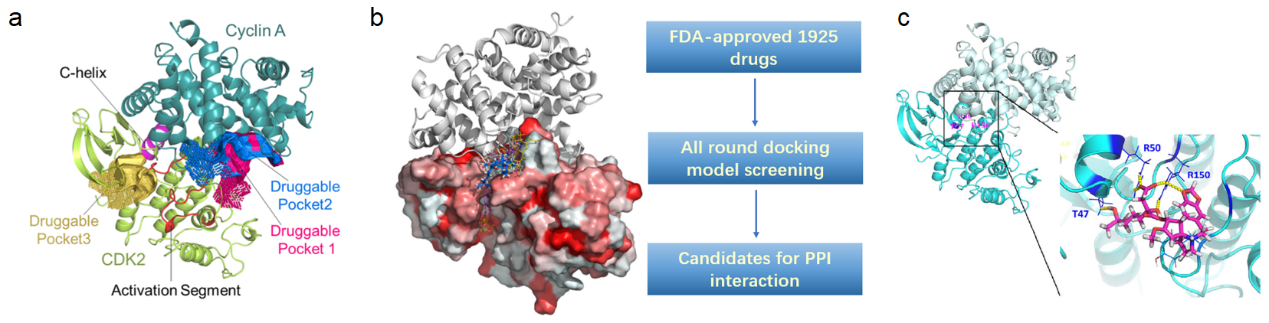
图1. HHT破坏了CDK2/Cyclin A之间的PPI
a. Cavityplus软件对CDK2/Cyclin A复合物可成药结构域的预测;b. LIVS (LIgand Virtual screening) pipeline对FDA批准的1952个小分子药物进行虚拟筛选;c. CDK2与HHT互作的分子模拟。
作者进一步研究发现HHT促进CDK2蛋白降解是由自噬-溶酶体途径介导的,通过互作蛋白质谱检测发现,Trim21 (tripartite motif containing 21) 蛋白在HHT诱导的CDK2自噬降解过程中发挥关键作用。并在体外细胞实验和体内动物模型中证明,HHT阻断CDK2与Cyclin A之间的互作,导致CDK2与Trim21的结合增强,进而通过Trim21招募自噬机器引起CDK2的自噬降解。
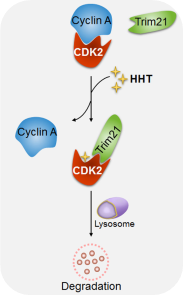
图2. 在肿瘤细胞中Trim21介导CDK2自噬降解的机制假说
HHT主要存在于三尖杉属植物中,2012年被美国FDA批准上市用于慢性粒细胞白血病(CML), 对于AML,HHT亦有非常好的疗效。我们的研究表明,HHT能直接与CDK2蛋白PPI位点结合,破坏CDK2与Cyclin A的相互作用,不仅能抑制CDK2的激酶活性,还能诱导其在肿瘤细胞中降解。因此,该发现可能为CDK2靶向癌症治疗开辟了一条新的途径,并为临床HHT精准用药提供理论基础。
浙江大学医学院附属第二医院张佳炜研究员,浙江大学遗传学研究所博士生甘宜超为本文共同第一作者。浙江大学遗传研究所/浙江大学医学院附属第二医院双聘研究员古莹,City of Hope黄文栋教授为本论文共同通讯作者。浙江大学医学院为本论文的第一通讯单位。该课题的开展得到科技部重点研发计划、国家自然科学基金和浙江省领军型创新团队的支持。
通讯作者简介
古莹博士,浙江大学医学院“百人计划”研究员,博士生导师,国家高层次人才项目入选者。2000-2007年于浙江大学临床医学七年制(学士硕士学位连续培养)专业就读并取得临床医学硕士学位;2007-2011年于浙江大学临床医学专业取得内科学(血液病学)博士学位;2011-2017年,任美国City of Hope国家医学中心博士后研究员;2018年至今任浙江大学医学院研究员,博士生导师。现任浙江大学遗传学研究所副所长,基础医学院遗传学系副主任。
长期从事恶性肿瘤发病机制及新的治疗靶点鉴定相关研究工作,在揭示肿瘤易感基因、新的特异性抗肿瘤靶标方面取得突出成绩,先后在国际肿瘤学和血液病学领域顶级期刊发表SCI研究论文十余篇,包括Cancer Cell, Nature Communications, Signal Transduction and Targeted Therapy, Blood, Leukemia等,研究成果被Cancer Discovery撰文特别点评,为恶性肿瘤特别是血液系统肿瘤的特异性治疗靶点的筛选以及有效靶向药物的研发提供了扎实有效的基础与理论依据。曾获“百人会”英才学者奖 。
古莹研究员实验室长期招收优秀博士后、科研助理加盟。有意者可发邮件至:[email protected]。
期待共同成长,携手探索前沿领域!












