生长抑素(又称生长激素抑制激素)是一种内源性的环肽,在胃肠道、胰腺、下丘脑、中枢神经系统等组织中广泛分布。在人体内,生长抑素通过抑制其它激素(如胰岛素、胰高血糖素、促甲状腺激素、生长激素以及胆囊收缩素等胃肠道激素等)的分泌,发挥主导的神经内分泌抑制作用。此外,生长抑素还参与调控细胞增殖和血管生成过程。人体中共有5种生长抑素受体(SSTR1-5),其中SSTR2是内分泌组织中的主要亚型,并且在神经内分泌癌中高表达,是临床上治疗垂体腺瘤和神经内分泌肿瘤的主要药物靶点。迄今为止,共有3种生长抑素类似物(lanreotide, octreotide,和pasireotide)上市,其中2种药物选择性靶向SSTR2。然而由于SSTR2的配体识别和选择性机制仍未揭示,极大地阻碍人们开发活性好、易口服、成本低的小分子类药物。
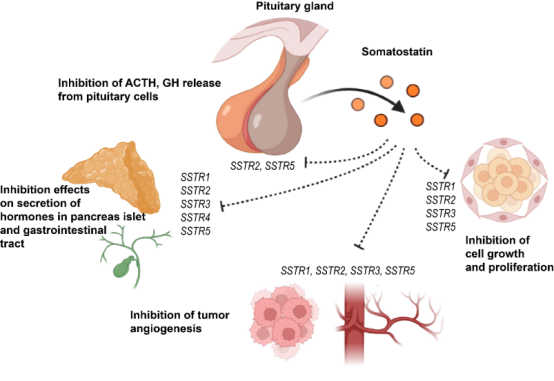
SSTR参与调控激素释放、细胞增殖等重要生理过程
2022年5月17日,浙江大学医学院附属邵逸夫医院毛春友研究员联合中国科学院大学附属肿瘤医院李清林教授在Cell Research上在线发表了题为“Structures of the endogenous peptide and selective non-peptide agonist-bound SSTR2 signaling complexes”的研究论文。本研究利用单颗粒冷冻电镜技术分别解析了SSTR2与内源性多肽激动剂(SS-14)和选择性小分子激动剂(L-054,264)复合物的高分辨电镜结构。结合细胞功能检测技术,本研究阐明了SSTR2多肽和小分子配体的识别模式,揭示了选择性小分子配体的受体选择性机制。

本研究具体发现如下:
(1)鉴定了激活的SSTR2与下游Gi蛋白复合物的高分辨电镜结构。
研究首先利用冷冻电镜技术解析了激活的SSTR2与下游Gi蛋白复合物的高分辨结构,整体分辨率达2.7 Å(图1)。结构分析表明,SSTR2呈现典型A类多肽GPCR的激活构象,包括7TM排列方式、胞外环2形成β-hairpin结构、TM3和ECL2之间保守的二硫键、以及受体保守的激活基序。此外,结构发现了SSTR2的TM2-3、TM5-6、ICL2-3和螺旋8参与下游G蛋白的偶联,主要与Gαi1的α5螺旋、β6和β2-β3环形成互作界面。有趣的是,多肽类激动剂以及小分子激动剂激活的SSTR2呈现出差异的受体构象以及下游效应蛋白偶联构象。

图1. SSTR2信号转导复合物的高分辨冷冻电镜结构
a,b.SS-14结合的SSTR2-Gi复合物的电镜密度(a)和结构模型(b)。c.内源性多肽SS-14和小分子激动剂L-054,264的电镜密度和模型。
(2)阐明了内源性多肽SS-14的结合模式和激活机制。
内源性多肽SS-14占据了由TM2-7和ECL2-3组成的正位结合口袋(图2)。其中多肽类激动剂保守的“W8-K9”基序深入插入7TM内部,而由二硫键连接(Cys3-Cys14)的多肽N和C端朝向细胞外侧。进一步的结构和功能分析发现了对多肽激动剂识别和激活至关重要的SSTR2残基:(1)由受体F1273.37、F2085.38和F2726.51残基组成的疏水口袋主要负责识别多肽激动剂保守的“W8”吲哚基团。(2)由受体D1223.32、Q1263.36和Y3027.43残基组成的负电荷空腔主要和多肽激动剂“K9”残基形成稳定的电荷和氢键相互作用。(3)ECL2广泛参与多肽类配体N端和C端残基的识别,对SSTR2肽激动剂的结合和激活是必需的。

图2. 内源性多肽SS-14的识别模式
a.SSTR2结合SS-14(紫色)的正构配体结合口袋(橙色)。b. SSTR2与多肽SS-14相互作用网络。c.SSTR2突变体细胞功能检测。
(3)揭示了非肽激动剂(L-054,264)的结合和受体亚型选择性机制。
相比于“0型”构象的多肽激动剂,小分子激动剂L-054,264采用“倒Y型”构象,形成较小的受体结合口袋(图3)。其中化学基团R1和R2主要模拟肽类激动剂的“W8-K9”基序,与受体形成类似的互作模式。不同的是,功能分析表明,相比于多肽激动剂,D1223.32在小分子激动剂的识别中尤为重要。此外,非肽激动剂的R3基团主要与TM6-7的胞外端残基形成强疏水相互作用。不同于多肽类激动剂的是,受体ECL2在小分子识别中无显著功能。基于同源模型结构分析和功能验证,研究发现非保守残基F2756.54、F2947.35和N2766.55参与了SSTR2对非肽激动剂L-054,264的R3基团的选择性识别。其中,F2756.54和F2947.35在SSTRs家族中仅存在于SSTR2中,与R3中的哌啶环和茚环结构形成强疏水堆积作用,是SSTR2被选择性识别的决定性因素。
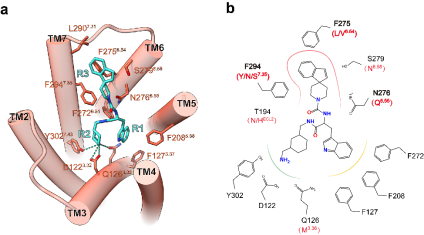
图3. 小分子激动剂L-054,264的识别和选择性机制
a.小分子配体L-054,264(青色)与SSTR2(橙色)的结合模式。b.参与L-054,264选择性识别的SSTR2残基示意图。
综上所述,本研究阐明了生长抑素受体SSTR2的配体识别、选择性以及下游信号转导机制,研究成果将极大地促进靶向SSTR2的药物发现,尤其是选择性小分子药物的开发。
浙江大学医学院博士研究生陈礼楠、博士后王伟伟、博士研究生董映君为论文共同第一作者;浙江大学医学院附属邵逸夫医院毛春友研究员和中国科学院大学附属肿瘤医院李清林教授为共同通讯作者;浙江大学基础医学院张岩教授对研究工作给予了重要指导和帮助;浙江大学冷冻电镜中心为数据收集提供了大力支持,研究工作得到了科技部、国家自然科学基金、浙江省自然科学基金的资助。
毛春友研究员所在结构药理与药物发现团队长期关注生命过程中关键膜受体的调控机制研究与干预分子发现,探索影响疾病发生发展和参与疾病调控的重要蛋白质的内在机制,致力于发现药物研发的创新靶点,探索靶标调控的新机制,发现创新活性分子,加速精准治疗的理论和技术创新。团队热烈欢迎有志于从事前沿基础和应用研究的各类人才。
详情请见:
http://zp.srrsh.com/index/index/announcement_desc/id/243.html












