聚集体自噬是清除细胞内毒性蛋白聚集体的重要途径,也是治疗聚集体相关疾病例如神经退行性疾病的重要靶点。在聚集体自噬过程中,自噬体如何选择性地识别蛋白聚集体一直是一个重要问题,而其中的机制也亟待进一步阐明。传统的聚集体自噬受体(P62、NBR1和TAX1BP1等)通过结合聚集体上的泛素链和自噬体膜上的LC3蛋白来介导聚集体自噬,但对于非泛素化底物形成的聚集体如何被自噬降解还知之甚少。
更为重要的是,目前所知聚集体自噬受体都是选择性靶向含有流动性的蛋白聚集颗粒,对于致病性的固态聚集体无法清除,因此想要通过靶向聚集体自噬治疗人类疾病,急需寻找特异的靶向固态聚集体的新型自噬受体。
2022年4月1日,浙江大学基础医学院/附属第一医院易聪课题组, 清华大学药学院张敏课题组和清华大学生命科学学院葛亮课题组合作在Cell杂志上在线发表题为“CCT2 is an aggrephagy receptor for clearance of solid protein aggregates”的研究论文,发现了一种新型的聚集体自噬受体CCT2在清除固态蛋白聚集体中的重要作用。

在此项研究中,研究人员发现了一种新型的聚集体自噬受体CCT2,能够促进多种与神经退行性疾病相关的毒性蛋白聚集体的自噬性清除。与传统聚集体自噬受体一样,CCT2能够与LC3和蛋白聚集体结合。不同的是,CCT2通过其顶端结构域(apical domain),以非泛素依赖的方式结合蛋白聚集体,这为CCT2特异性地识别聚集体提供了结构基础。
重要的是,研究发现CCT2和传统的聚集体自噬受体在对聚集体状态的选择上有很大差异:传统的自噬受体更倾向于降解有流动性的液态聚集体,而CCT2则更倾向于选择固态聚集体。因此,相比已知的聚集体自噬受体,CCT2更有可能在病理状态下发挥作用并成为药物靶点(图1)。
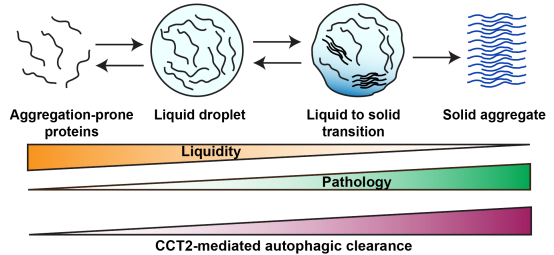
图1. 聚集体的相变与固化以及CCT2介导固态聚集体的清除
CCT2是分子伴侣Chaperonin复合体的一个亚基,与复合体一起作为分子伴侣帮助错误折叠的蛋白正确折叠。进一步研究发现,CCT2以单体形式介导聚集体自噬,因为只有单体形式的CCT2能够暴露出与LC3的结合位点VLIR 结构域。
有趣的是,聚集体的存在阻碍了Chaperonin复合体的形成,从而释放出更多的CCT2单体来促进聚集体清除。CCT2从复合体到单体的转变,使其功能从分子伴侣转变为自噬受体。这既能够在聚集体形成前防止错误折叠的蛋白发生聚集,又能在发生聚集后介导聚集体的清除,从而为维持细胞内的蛋白稳态提供了一种高效方式(图2)。
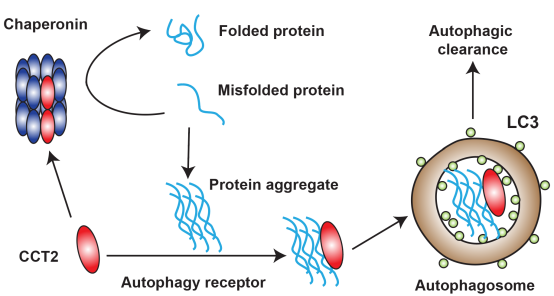
图2. CCT2的分子伴侣和自噬受体功能转换
随后,蛋白聚集体自噬受体CCT2的功能和结构的保守性在酵母细胞中得到了进一步验证。CCT2在体内体外实验结果表明CCT2可以与Atg8结合(LC3在酵母细胞中的同源物),对CCT2与Atg8结合的保守序列进行突变后,显著降低CCT2和Atg8结合水平,同时也发现酵母中的CCT2参与了固态聚集体Ape1 P21L的清除。
综上所述,本研究揭示了CCT2作为蛋白聚集体自噬的受体,在生物进化过程中具有高度保守性,更倾向于选择固态的聚集体进行降解,极有可能成为潜在的药物靶点。
浙江大学基础医学院/附属第一医院易聪研究员,清华大学药学院张敏研究员和清华大学生命科学学院葛亮副教授为本文的共同通讯作者,清华大学生命科学学院博士生马欣宇为第一作者,清华大学为第一完成单位。易聪课题组成员陈禹亭,姚伟静和陈颖聪主要参与了CCT2在酵母细胞中的功能和结构研究。
此研究得到了国家基金委、科技部、北京自然科学基金委、浙江省自然科学基金委和清华大学-北京大学生命科学联合中心等经费的支持。
实验室简介
易聪研究员课题组主要研究方向:
1. 细胞基础自噬发生的分子机理及其生理病理意义;
2. 能量代谢与细胞稳态之间的内在关联。
本课题组长期招聘博士后研究人员以及博士研究生,欢迎热爱科研的你加入!
教师个人主页:https://person.zju.edu.cn/yclab












