2021年3月10日,浙江大学基础医学院柯越海教授团队在Journal of Extracellular Vesicles杂志在线发表了题为“Phosphatase Shp2 regulates biogenesis of small extracellular vesicles by dephosphorylating Syntenin”的研究论文。该研究发现一组酪氨酸磷酸酶调控细胞外囊泡(extracellular vesicles)的合成与分泌,阐明了其中的磷酸酶PTPN11/Shp2通过去磷酸化修饰负向调控肺泡上皮细胞外泌体的生成,提示了磷酸酶参与肺部炎症微环境的新的作用途径。

外泌体(Exosome)是细胞外囊泡的一种主要形式,基本结构为20-200 nm的纳米级膜结构,近年来研究显示外泌体是细胞间信息传递的主要载体,在生理或病理条件下,外泌体合成与释放可介导各类生物活性分子传递,广泛参与调控疾病发生发展进程,解析外泌体调控机制有望深入理解复杂微环境信号转导的共性特征。
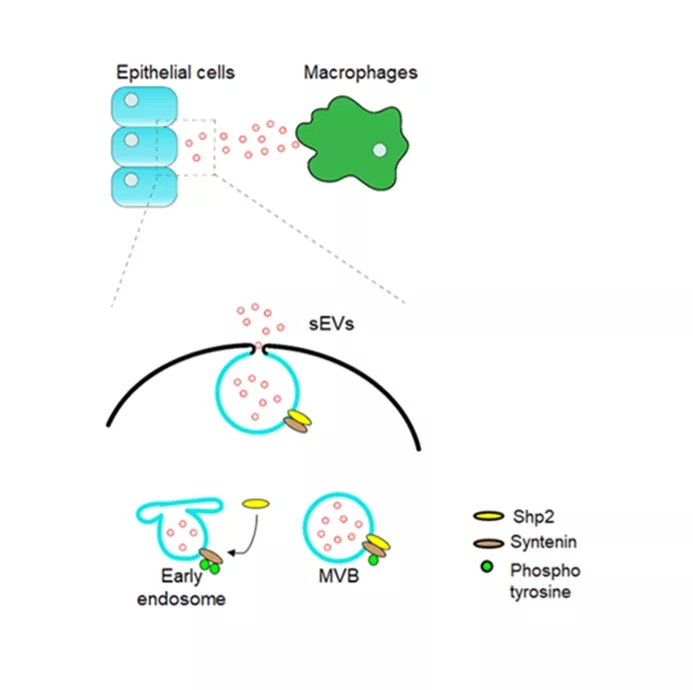
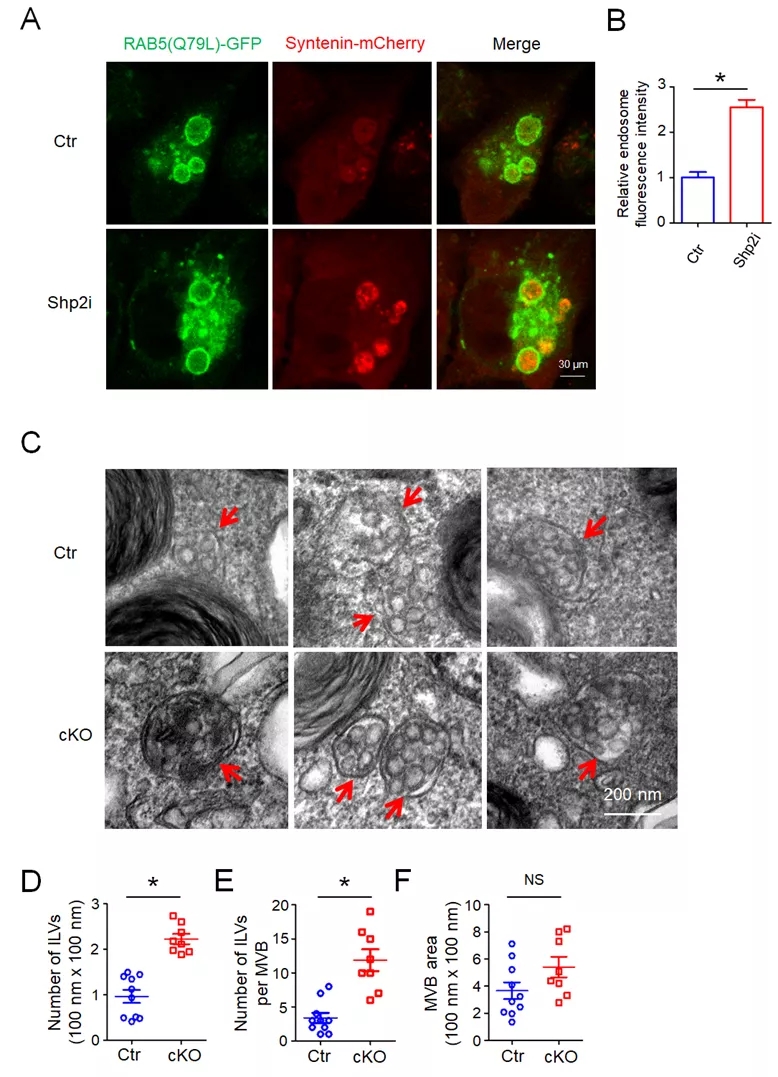
磷酸化效应是信号调控的重要的翻译后修饰方式,是解析分子机制的生化基础,也是药物干预的关键靶点,其中酪氨酸磷酸化是广受关注的新药靶点。该研究首先发现一种非受体型酪氨酸磷酸酶PTPN11/Shp2缺失或者抑制会显著增加多种细胞的外泌体分泌,通过筛选并鉴定了磷酸酶PTPN11/Shp2可直接修饰外泌体生成的关键蛋白 Syntenin第46位酪氨酸的去磷酸化,进而影响Syntenin-Alix胞内复合物,控制囊泡转运的内体分选复合体(ESCRT)形成。该研究首次发现去磷酸化修饰是胞外囊泡的合成与分泌的一个潜在的控制因素,有多种酪氨酸磷酸酶参与了该过程的调控,Shp2信号是其中一个关键途径。同时,研究结合基因修饰动物模型进一步显示抑制肺泡上皮Shp2缺失可促进多囊泡形成,在炎症条件下介导肺泡巨噬细胞活化,提示了炎症环境下肺泡上皮细胞与巨噬细胞的相互作用的新途径,为理解肺损伤与炎症微环境的调控机制提供新的线索。
浙江大学基础医学院博士生张越飞、李仪青为论文第一作者,柯越海、张雪为论文的共同通讯作者。该研究受到了国家自然科学基金重点项目,科技部重点研发计划等资助。












