2021年2月8日,浙江大学基础医学院、浙江大学医学院附属邵逸夫医院潘冬立教授课题组在Nature Microbiology在线发表了题为“Regulation of host and virus genes by neuronal miR-138 favours herpes simplex virus-1 latency”的研究论文,发现一个神经特异性宿主microRNA(miR-138)可以通过联合调控病毒与宿主基因帮助单纯疱疹病毒I型(HSV-1)潜伏。
HSV-1是广泛感染人类的传染性病原体,主要以潜伏状态存在于人体,活跃时可以引起口唇疱疹、疱疹性角膜炎、新生儿疱疹和疱疹病毒脑炎等多种疾病。HSV-1的一个重要特点是感染外周组织后进入神经元进行潜伏感染,从而逃避宿主免疫,当宿主免疫力下降或受应激因素刺激后,潜伏的病毒又可以再激活进行复发感染。潜伏与再激活能力是在免疫与药物存在的情况下HSV-1依然可以传播和致病的关键原因。
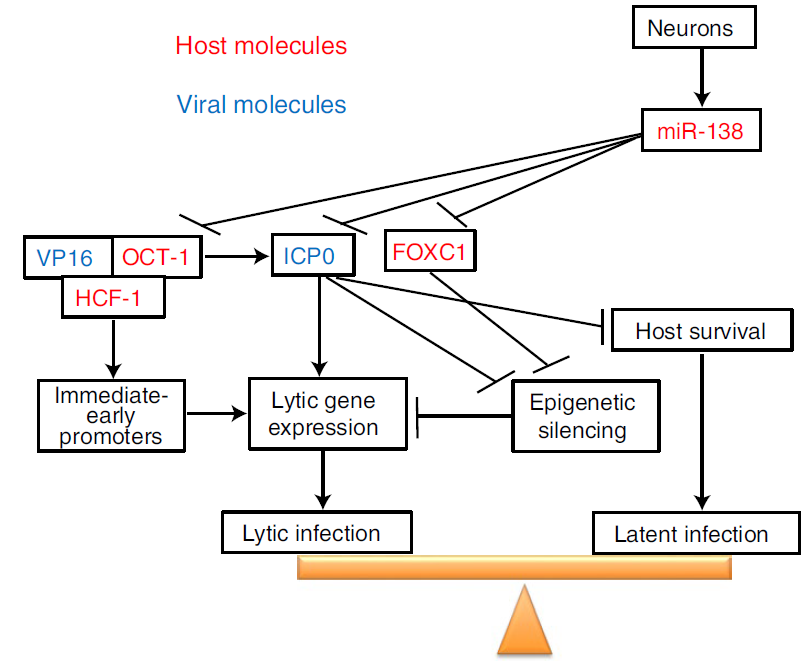
潘冬立课题组在发现神经特异性microRNA(miR-138)可以与病毒ICP0转录本结合的基础上,发现除了靶向ICP0,miR-138也可以通过不依赖于ICP0的方式在细胞和小鼠中抑制病毒复制。经过联合应用RNA-seq、PAR-CLIP、siRNA等技术,潘冬立课题组发现miR-138可以抑制两个宿主转录因子OCT-1和FOXC1的表达,而这两个宿主因子都对HSV-1复制非常重要。OCT-1是已知的可以帮助HSV-1启动转录的宿主因子,而FOXC1是课题组新发现的宿主调控因子。
接下来课题组发现FOXC1在小鼠体内和体外的神经组织和细胞中均能显著促进HSV-1复制。在机制方面, FOXC1不仅可以普遍促进病毒基因转录,而且可以降低结合到HSV-1基因组上的异染色质水平,说明它可以削弱细胞的表观遗传基因沉默机制。有趣的是,有研究表明ICP0也有类似的表观遗传调控机制,而且课题组发现FOXC1可以弥补ICP0缺失病毒在复制方面的缺陷。综合起来,课题组发现神经细胞中特异性高表达的miR-138可以同时调控病毒的ICP0基因及宿主的OCT-1和FOXC1基因,而这些调控作用趋同性的抑制病毒裂解性基因表达,从而为HSV-1潜伏创造有利条件。
浙大基础医学院硕士研究生孙博强和杨雪伟、博士后侯富军为该研究的共同第一作者,技术员于晓凤和硕士研究生王琼艳及美国哈佛医学院的多位合作者也参与了该研究。该研究获国家重点研发计划项目与国家自然科学基金支持。
原文链接:https://www.nature.com/articles/s41564-020-00860-1#author-information












